24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
新版GCP之下,SAE/SUSAR该如何进行上报?先来了解一下什么是SAE?什么是SUSAR?跟随小编的脚步一起看看SAE和SUSAR的关系,最后再来探讨上报。正文如下:

什么是SAE?什么是SUSAR?
SAE(严重不良事件,Serious Adverse Event,SAE),指满足以下情形中一条或多条的不良事件:
1、导致死亡;
2、危及生命,指严重病人即刻存在死亡的风险,并非是指假设将来发展严重时可能出现死亡;
3、导致住院或住院时间延长;
4、永久或显著的功能丧失;
5、致畸、致出生缺陷;
6、其他重要医学事件:必须运用医学和科学的判断决定是否为重要医学事件,可能不会立即危及生命、死亡或住院,但需要采取医学措施来预防如上情形之一的发生。
SUSAR(可疑非预期严重不良反应,Suspected Unexpected Serious Adverse Reaction,SUSAR):所有与试验药物或上市后药品肯定相关或可疑的非预期且严重的不良反应。
SAE与SUSAR的关系?
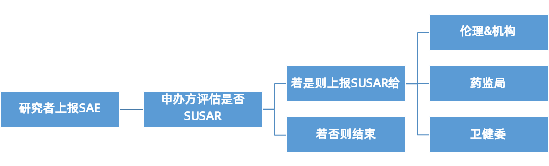
SAE/SUSAR该如何进行上报?
1、报告填写与确认
按照ICH E2B(R3)标准字段进行SAE信息的填写。研究者对SAE报告进行审核,确保报告内容完整、准确,进行审阅、进行必要的修改,完成严重性判断及因果评价,以供申办者评估。既往我们填写得比较多的是国家药监局提供的版本,目前有部分申办方选择在原有的模版基础上有部分的修改,需要研究者在模版的提示下进行收集,上报的过程中确认使用哪个版本。
2、报告时限
研究者应在获知SAE的24小时内(除方案另有规定)将报告发送至申办者。针对SUSAR报告,申办者应当遵循7天和15天的快速报告要求向研究者、临床试验机构及伦理委员会递交。即:
(1) 对于致死或危及生命的SUSAR,申办者应在首次获知后7天内递交,并在随后的8天内报告、完善随访信息(申办者首次获悉当天为第0天);
(2) 对于非致死或危及生命的非预期严重不良反应(SUSAR),申办者应在首次获知后15天内递交。
3、回执确认
所有递交动作均应有回执:
(1) 申办者收到研究者报告的SAE后,向研究者发送收到回执;
(2) 申办者向研究者、本机构、本伦理中心分发SUSAR报告后,均应获得相应的回执,以作为有效送达之证明。【接收者通过邮件进行回复,确认已收到,并审阅该安全性文件。邮件的自动回复,不可以作为有效回执。】{当使用信息化系统时,可以使用电子签名作为查阅的回执。【通过信息化系统进行安全性报告的分发,所有接收者按照系统操作指引进行审阅并电子签名。电子签名内容包括:手写签名图片+签名时间+此签名的含义。
新版GCP要求之下,对于SAE的上报相对旧版的要求及流程更加的简化,但是对于SUSAR的关注及要求明显提升,我们在涉及到此类文件的相关递交过程中,务必注意文件内容的审核,以及相关时限的要求,做到及时递交。
来源:普蕊斯
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
奇亿娱乐(中国)有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。