在做
医疗器械注册之前是需要确认自己预申请的产品是几类产品以及是否是属于医疗器械范畴的,避免从一开始就做无用功。当然,如果和医疗器械分类目录功效一致的话就不需要再做医疗器械
分类界定了。另外,切忌不要凭主观意愿去申报产品类别。那么
医疗器械分类界定详细服务流程及所需材料都需要准备什么,一起来看下吧!
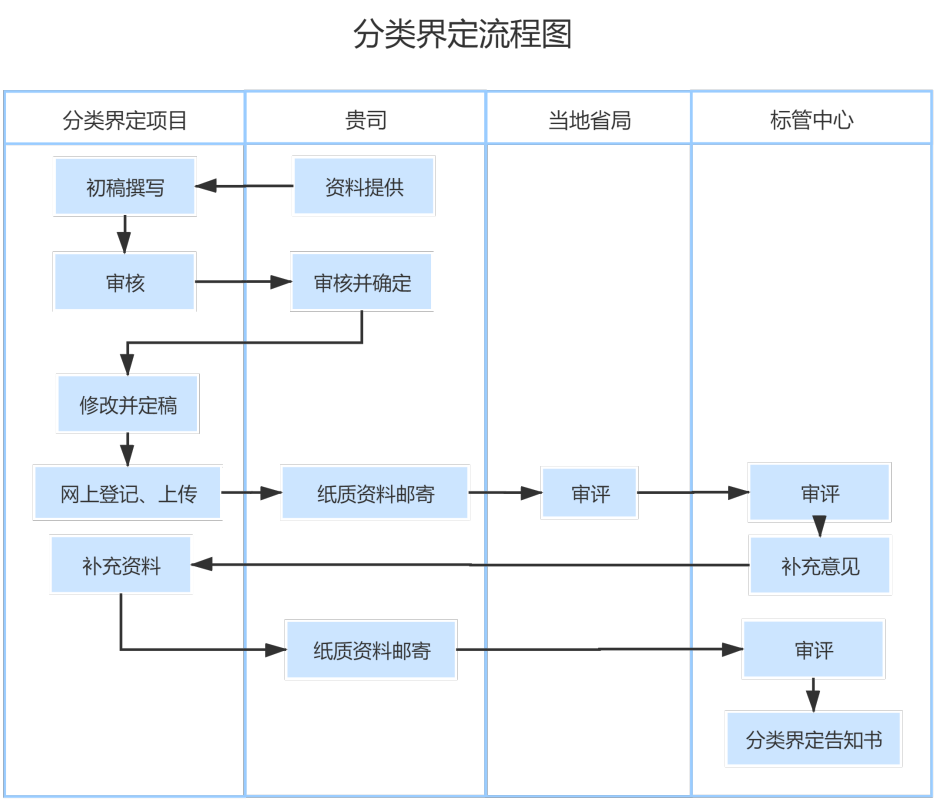
医疗器械分类界定详细服务流程
医疗器械分类界定所需材料
首先,做医疗器械分类界定不需要样机的,仅需以下的材料:
1、产品照片或示意图
2、分类界定申请表
3、产品技术要求
4、产品说明书
分类界定申请表要到药监局网站上申请下载填表,自申请之日起20个工作日内完成类别确认工作(补充资料及专家研讨会所需时间不计算在时限内)。需要补充资料的,申请人应当在30个工作日内按照补正通知的要求一次提供补充资料。
医疗器械分类界定注意点
1、可以用功效性的名词:修复 而不是假似词:修护
2、含有药物成分、中药材(或天然植物)及其提取物的医用产品,以医疗器械作用为主的药械组合产品,按照第三类医疗器械管理。
3、可被人体吸收的医疗器械,按照第三类医疗器械管理。
4、无菌提供的医疗器械,不低于第二类医疗器械管理。
5、矫形器械,不低于第二类医疗器械管理。
6、用于供有生产资质的厂家进行组装、包装、灭菌等进一步加工的半成品不作为医疗器械管理。
7、产品名称要符合《医疗器械通用名称命名规则》;产品技术要求需符合产品技术要求编写指导原则;说明书需符合总局6号令规定;
8、补充资料需要在30个工作日内,回复时需要同时提供Word版和PDF版(盖章扫描),并注明“XX产品分类界定补充资料(受理号:XXXX))”,补充资料需要邮寄纸质资料,省局发出的补充资料需要邮寄到受理省局,标管局发出的补充资料需邮寄到中国食品药品检定研究院。未能在指定时间内完成补充资料并提交的,停止审批。
9、存在界定产品不属于医疗器械的情况