24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
“一套医疗器械临床试验立项资料通行山东” ——山东省发布医疗器械临床试验立项资料提交标准
2020年8月1日,山东省58家临床试验机构联合成立区域临床研究协作组,为了加快山东省临床研究能力和水平,优化区域内各临床试验机构管理流程,为申办者、CRO提供一站式快捷服务,吸引更多的更优质的临床试验项目在山东开展,山东省区域临床研究协作组将开展一系列“一套药物/器械临床试验立项资料通行山东”的临床试验资料标准、相关地方共识以及伦理互认的活动。经过协作组近三个月的充分准备、讨论、征求意见、最终定稿,现在发布山东省医疗器械临床试验立项资料目录提交标准和相关注释(见附件1)。
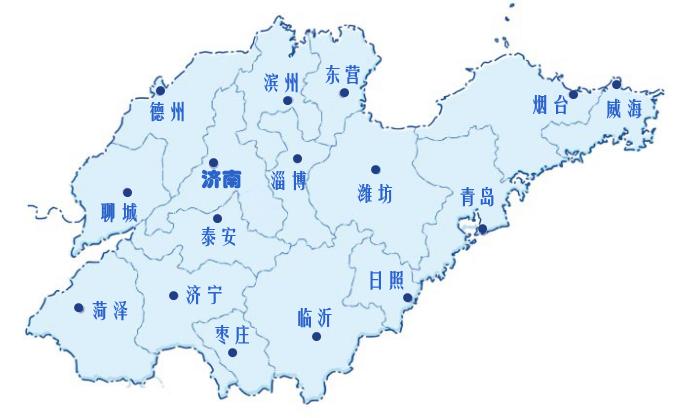
(一套医疗器械资料通行山东▲)
自本标准发布之日起,加入山东省临床研究协作组的各临床试验机构(临床试验机构名单见附件2)决定将统一采用一套医疗器械临床试验立项资料目录。各申办者和CRO可以一套立项资料通行山东各机构开展临床试验项目。切实为申办者和CRO提供优化、快捷的立项流程服务,节约时间成本。如果合作方在立项过程中发现附件2中的机构不遵守该规定的,请及时与山东省区域临床研究协作组联系,经协作组督促仍不执行的,协作组将取消该机构的成员资格。
欢迎各申办者和CRO组团考察山东省各临床试验机构,给予我们管理上、项目上以及其他合作方式上的指导与帮助,目前已经在或准备在山东各机构开展项目正在立项的,可以快捷的通行各合作临床试验机构。各合作方有意在山东选点需要山东省区域临床研究协作组协调的,可以与山东省区域临床研究协作组秘书处联系,也可以直接和各临床试验机构联系。同时,山东省区域临床研究协作组欢迎各方各界为山东各临床试验机构提供各种有利于山东省医药产业发展、平台建设、区域合作、临床试验能力和水平提高的帮助和指导。
附件2适用机构名单将定期更新,如有愿意加入适用机构名单的,可以和山东省区域临床研究协作组联系。
欢迎协作组成员单位公众号及自媒体转发。
欢迎其他省份的各组织或者临床试验机构联合发布,适用省份或城市接龙,扩大医疗器械临床试验立项资料目录适用的地域和机构。
山东省区域临床研究协作组秘书处联系邮箱shandonggcp@126.com。
附件1.医疗器械临床试验立项资料目录提交标准和相关注释(通行版)
附件2.医疗器械临床试验立项资料目录提交标准(通行版)适用机构名单
山东省区域临床研究协作组
2020年12月22日
附件1
版本号:1.0 生效日期:2020.12.22
| 序号 | 资料名称 | 备注 |
| 1 | 申办者或CRO委托临床试验机构进行临床试验的委托函 | 纸质版需要提供盖章的原件 |
| 2 | NMPA审批证明或备案证明 | 第三类医疗器械进行临床试验对人体具有较高风险的,需经过NMPA批准 |
| 3 | 申办者的资质证明文件(营业执照;生产许可证等。) | 委托生产需提供委托生产说明及被委托方资质 |
| 4 | 申办者委托CRO的委托函及CRO营业执照(如适用) | 委托函应为双方盖章件 |
| 5 | 中心实验室或第三方实验室委托函、资质证明文件及室间质评证书(如适用) | 无中心实验室或第三方实验室可不提供 |
| 6 | 监查员委托函、简历及资质 | 资质包括:身份证复印件、GCP证书(近三年)、毕业证、学位证 |
| 7 | 申办者/CRO委托SMO的委托函及SMO的营业执照(如适用) | 无SMO可不提供 |
| 8 | 申办者、CRO、统计单位等试验参加单位信息表 | 根据实际情况填写参加单位信息 |
| 9 | 我国人类遗传资源采集、保藏、利用、对外提供的既往审批/备案材料(申请书、受理文件、批件、备案证明等) | 如不涉及遗传资源审批的需提交说明 |
| 10 | 组长单位的伦理批件和成员表 | 本中心为组长单位的可不提供,如果组长单位伦理为修改后同意,需提供审查意见函和伦理同意的审批件 |
| 11 | 研究者手册(注明版本号,版本日期)(如适用) | 如有实验室操作手册也放到此项下 |
| 12 | 试验方案(注明版本号、版本日期) | 需有组长单位PI签字页复印件,需要申办者和统计单位等的签字页复印件有本中心PI签字页原件,需通过组长单位伦理批准;本中心为组长单位者可不提供组长单位PI签字和伦理审查批件 |
| 13 | 病例报告表(或电子病例报告表或EDC)样表(注明版本号,版本日期) | 可提供电子版或纸质版 |
| 14 | 研究病历样表(注明版本号、版本日期) | 如不适用研究病历可不提供 |
| 15 | 知情同意书(注明版本号、版本日期) | 知情同意书需按照GCP的要求知情要素完整,且通俗易懂,签字页要签名、签日期,留有电话,并规定监护人和第三方见证人签字的说明 |
| 16 | 受试者招募广告(如适用) | 含版本号、版本日期。招募广告要写明发布的渠道(例如是易拉宝、官网还是微信公众号,如有需要可根据不同发布渠道提供多个版本)。 |
| 17 | 其他受试者相关材料(如适用) | 如受试者须知等宣教材料,受试者日记卡,受试者评分表等 |
| 18 | 试验用医疗器械自检合格报告和具有资质的检验机构出具的1年内的产品注册检验合格报告 | |
| 19 | 试验用医疗器械的研制符合适用的医疗器械质量管理体系相关要求的声明 | |
| 20 | 产品的动物试验报告 | 仅限首次用于植入人体的医疗器械提供 |
| 21 | 临床试验保险证明 | 包括保险单+保险副本。如为外文凭证,需提供中文翻译版本,并提供两个版本一致性说明 |
| 22 | 盲法试验的揭盲程序(如适用) | 试验不设盲时可不提供 |
| 23 | 本中心拟参加本试验的研究者名单 | 包括姓名、专业、职称、初步分工等 |
| 24 | 本中心拟参加本试验的研究者资质 | 包括:研究者简历原件(本人签名签日期)、以下复印件:GCP证书(近三年)、相关执业证书 |
| 25 | 研究者利益冲突声明 | |
| 26 | 申办者保证所提供资料真实性的声明 | |
| 27 | 研究者保证所提供资料真实性的声明 | |
| 28 | 医疗器械临床试验申请表 | 由各临床试验机构提供,可根据各机构的模板填写 |
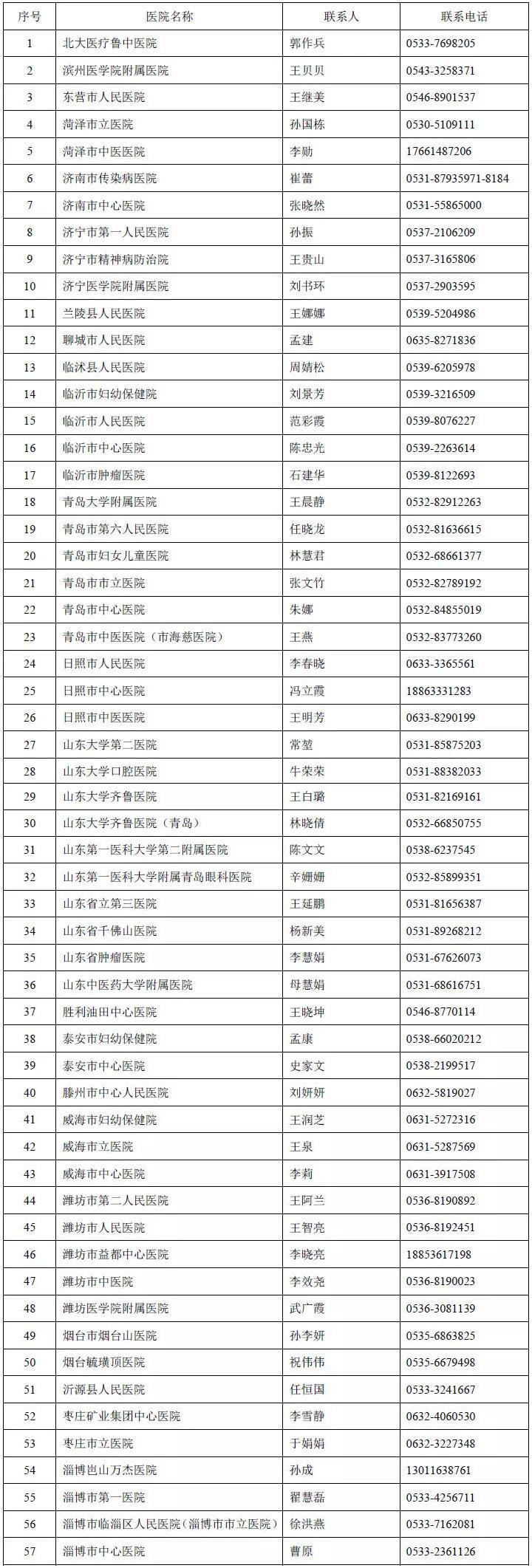
附件2
版本号:1.0 生效日期:2020.12.22
以下临床试验机构决定自该目录发布之日起,统一使用该医疗器械临床试验立项资料目录,各机构承诺在更适用本机构的前提下,可根据实际情况在此基础上减少,不再此基础上增加另外需求。
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
奇亿娱乐(中国)有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。