24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
附件:脊柱植入物临床评价质量控制注册技术审查指导原则(2020年第31号).doc
本指导原则是对注册申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他技术论证方法,也可以采用,但是需要提供详细的研究资料和论证资料。企业应在遵循相关法规和技术标准的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前科学认知水平下制定的,是对脊柱植入物临床评价内容和分析原理的进一步阐释,所例举产品有限,尚不能涵盖所有脊柱植入物产品细节,对于某些专项问题的处理方法,尚需针对性的指导原则进行深入论述,例如临床数据汇总分析的技术和决策。随着法规和标准的不断完善,以及技术审评科学的不断发展,本指导原则相关内容也将进行适时的调整、补充和更新。
一、适用范围
本指导原则适用于椎体融合植入物、椎体非融合假体、刚性内固定系统、动态非融合内固定系统及骨填充物等脊柱植入物注册申报时的临床评价工作,旨在为注册申请人/生产企业按照《医疗器械临床评价技术指导原则》(国家食品药品监督管理总局通告2015年第14号)要求进行相关产品的注册申报提供技术指导,同时也为药品监督管理部门对注册申报资料的审评提供技术参考。
本指导原则系对脊柱植入物临床评价分析方法的通用指导,以确保临床评价内容的质量,并非临床评价资料的内容格式,其它无源骨植入物的临床评价也可参考借鉴其中适用和合理的部分。注册申请人应依据具体产品的特性对临床评价资料的内容进行充实和细化,并依据具体产品的特性确定其中所适用的细节内容。若不适用,需具体阐述理由及相应的科学依据。
二、脊柱植入物临床评价基本思路
脊柱植入物临床评价基于设计开发的基本过程,临床数据的评价是完成设计开发确认的主体部分,非临床研究是设计开发验证的主体,其结果决定了设计开发确认时对临床证据的需求,以及临床数据处理的工作量,临床数据的评价是完成设计开发确认的重要组成部分。无论申报产品列入《免于进行临床试验的医疗器械目录》(国家食品药品监督管理总局通告2018年第94号)、通过同品种医疗器械临床试验或临床使用获得的数据进行分析评价,还是在中国境内进行了临床试验,在按照《医疗器械临床评价技术指导原则》附1、2、3中的对比内容要求或附8分析评价报告的格式要求准备临床评价资料时,临床评价都应遵循产品设计开发的共性思路,确保以“临床”为导向,以“病患”为中心做出决策。以同品种评价路径及其设计开发思路为基础,图1例举了较完整和通用的一种分析思路。免于进行临床试验的产品或在境内进行了临床试验的产品,通常是该思路中的一部分分支,此时图中的“同品种”将替换为“同类产品”,在具体型号规格、性能指标或宣称内容的设定中,会借鉴该图中的分析思路。
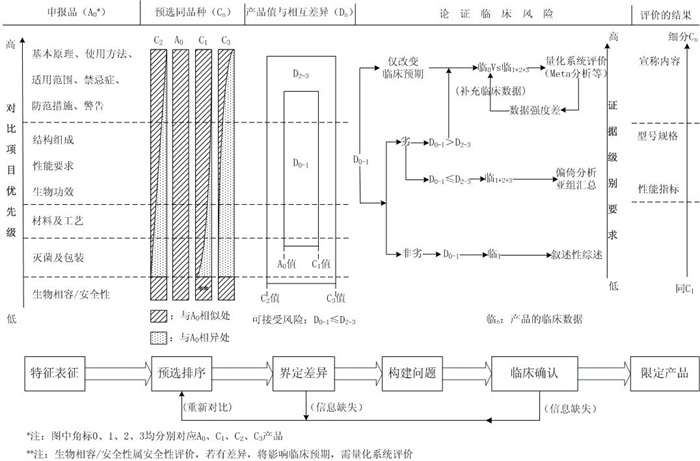
图1 同品种途径分析思路举例(同类产品可借鉴)
图1所例举的脊柱植入物临床评价分析思路,按照由上到下,由左到右的顺序进行阅读。整体分为“特征表征”、“预选排序”、“界定差异”、“构建问题”、“临床确认”和“限定产品”六个分析阶段,图的顶端明确了各阶段所对应的分析对象:申报品、同品种、数值差异、临床风险、评价结果。
(一)“特征表征”阶段:
依据与作为设计开发确认的临床研究数据的关联度,将同品种途径临床评价对比项目,进行了优先级的重排,并根据对比项目之间的相关性划分为5组。该5组划分将贯穿六个思考阶段的始终,用于临床评价结局时限定申报产品的最终特征。该特征表征重在将申报品表征清晰,在下一步预选同品种的阶段,也将按照对比项目对同品种进行表征。所有特征均属于非临床研究的范畴,“临床研究”特指来自医疗机构的临床数据。
......
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
奇亿娱乐(中国)有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。