24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
附件:麻醉咽喉镜注册技术审查指导原则(2018年第30号).doc
本指导原则旨在指导注册申请人准备及撰写麻醉咽喉镜注册申报资料,同时也为技术审评部门审评注册申报资料提供参考。
本指导原则是对麻醉咽喉镜的一般性要求,申请人应根据产品的特性,判断指导原则中的具体内容是否适用,不适用内容应详述理由。并依据产品的具体特性对注册申报资料的内容进行充实和细化。

本指导原则是供申请人和审查人员的指导性文件,不涉及注册审批等行政事项,亦不作为法规强制执行,如有能够满足法规要求的其他方法,也可以采用,但应提供详细的研究资料和验证资料。应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准体系的不断完善和科学技术的不断发展,本指导原则相关内容也将适时进行调整。
一、适用范围
本指导原则适用于按第二类医疗器械管理的麻醉咽喉镜产品,包括重复使用的麻醉咽喉镜和一次性使用麻醉咽喉镜,对于仅包括窥视片、不包括手柄的产品,本指导原则也可参照执行。参考《医疗器械分类目录》(国家食品药品监督管理总局公告2017年第104号),产品的分类编码为08—05—06(呼吸、麻醉和急救器械—呼吸、麻醉、急救设备辅助装置—气管插管用喉镜)。
本指导原则不适用于带有视频功能的喉镜产品和与之配套的喉镜片。
二、技术审查要点
(一)产品名称要求
产品中文名称应遵循《医疗器械通用名称命名规则》(国家食品药品监督管理总局令第19号)等相关法规、规范性文件的要求。产品名称应以体现产品的工作原理、技术结构特征、功能属性为基本准则,如“麻醉咽喉镜”“一次性使用麻醉咽喉镜”。
(二)产品的结构和组成
麻醉咽喉镜由窥视片和手柄组成,按照结构的不同,分为连体式和分体式;按照光源不同,分为LED光源式、灯泡光源式;按照导光方式不同,分为直接照明式和纤维导光束照明式;窥视片可按照形式的不同,分为弯型、直型、弯钩型等;按照使用次数可以分为可重复使用和一次性使用产品。
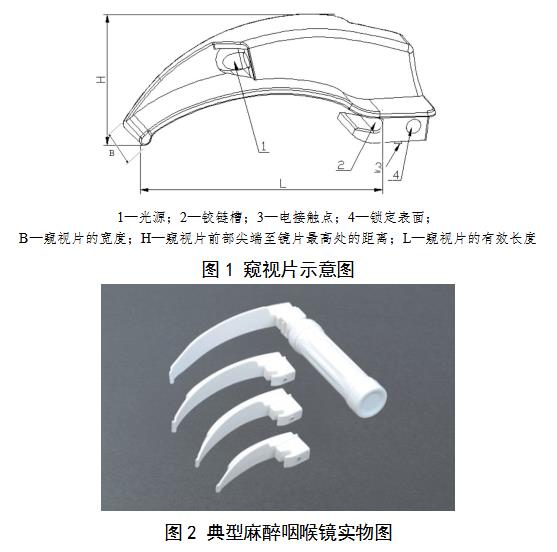
说明麻醉咽喉镜的结构,提供产品结构示意图及实物图(如图1、图2)。
1—光源;2—铰链槽;3—电接触点;4—锁定表面;
B—窥视片的宽度;H—窥视片前部尖端至镜片最高处的距离;L—窥视片的有效长度
(三)产品工作原理/作用机理
麻醉咽喉镜由窥视片和手柄组成,当电源接通后,窥视片插入患者的口腔中并压住舌部,光束可集中照射于咽喉部位。供临床喉部检查、协助插管用。
描述产品的工作原理、主要功能及其组成部件(关键组件)的功能,以及区别于其他同类产品的特征等内容。
(四)注册单元划分的原则奇亿娱乐例
依据《医疗器械注册单元划分指导原则》(国家食品药品监督管理总局通告2017年第187号)的相关要求,由于一次性使用麻醉咽喉镜与可重复使用麻醉咽喉镜的原材料、生产工艺(含灭菌方式)存在明显差异,应划分为不同的注册单元;分体和连体的麻醉咽喉镜,如区别仅为窥视片与手柄是否分离,可以划分为同一注册单元。
(五)产品适用的相关标准
如表1列出麻醉咽喉镜主要涉及的现行有效的国家/行业标准;如有标准发布或更新,应当考虑新版标准的适用性。
表1 产品适用标准
| 标准编号 | 标准名称 |
| GB/T 191—2008 | 包装储运图示标志 |
| GB/T 2828.1—2012 | 计数抽样检验程序第1部分:按接受质量限(AQL)检索的逐批检验抽样计划 |
| GB/T 2829—2002 | 周期检验计数抽样程序及表(适用于对过程稳定性的检验) |
| GB 9706.1—2007 | 医用电气设备第1部分:安全通用要求 |
| GB/T 14233.1—2008 | 医用输液、输血、注射器具检验方法第1部分:化学分析方法 |
| GB/T 14710—2009 | 医用电器环境要求及试验方法 |
| GB/T 15593—1995 | 输血(液)器具用软聚氯乙烯塑料 |
| GB/T 16886.1—2011 | 医疗器械生物学评价第1部分:风险管理过程中的评价与试验 |
| GB/T 16886.5—2003 | 医疗器械生物学评价第5部分:体外细胞毒性试验 |
| GB/T 16886.10—2005 | 医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验 |
| GB/T 19633.1—2015 | 最终灭菌医疗器械包装第1部分:材料、无菌屏障系统和包装系统的要求 |
| GB/T 19633.2—2015 | 最终灭菌医疗器械包装第2部分:成形、密封和装配过程的确认的要求 |
| YY/T 0287—2017 | 医疗器械质量管理体系用于法规的要求 |
| YY/T 0313—2014 | 医用高分子产品包装和制造商提供信息的要求 |
| YY/T 0316—2016 | 医疗器械风险管理对医疗器械的应用 |
| YY/T 0466.1—2016 | 医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求 |
| YY 0498.1—2004 | 喉镜连接件第1部分:常规挂钩型手柄-窥视片接头 |
| YY 0498.2—2004 | 喉镜连接件第2部分:微型电灯螺纹和带常规窥视片的灯座 |
| YY 0499—2004 | 麻醉喉镜通用技术条件 |
| YY 0505—2012 | 医用电气设备第1—2部分:安全通用要求并列标准电磁兼容要求和试验 |
| YY/T 0681系列标准 | 无菌医疗器械包装试验方法 |
| YY/T 0698系列标准 | 最终灭菌医疗器械包装材料 |
| YY/ T1474—2016 | 医疗器械可用性工程对医疗器械的应用 |
| ISO 14155—1:2003(E) | 用于人体的医疗器械的临床研究第1部分:一般要求 |
| ISO 14155—22003(E) | 用于人体的医疗器械的临床研究第2部分:临床研究计划 |
| / | 中华人民共和国药典(2015版) |
产品适用及引用标准的审查可以分两步来进行。首先对引用标准的齐全性和适宜性进行审查,也就是在编写注册产品技术要......
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
奇亿娱乐(中国)有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。