24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
附件:硬性光学内窥镜(第二类)注册技术审查指导原则(2017年修订版).doc
本指导原则旨在为技术审评部门审评注册申报资料提供参考,同时也指导注册申请人对第二类硬性光学内窥镜注册申报资料的准备及撰写。
本指导原则是对第二类硬性光学内窥镜的一般要求,审评人员和申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需申请人具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。第二类硬性电子内窥镜和硬性纤维内窥镜可参考本指导原则中适用的内容。

本指导原则是供审评人员和申请人使用的指导文件,不涉及注册审批等行政事项,亦不作为法规强制执行,如有能够满足法规要求的其他方法,也可以采用,但应提供详细的研究资料和验证资料,应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规、标准体系及当前认知水平下制定的,随着法规、标准体系的不断完善和科学技术的不断发展,本指导原则相关内容也将适时进行调整。
一、适用范围
本指导原则适用于第二类观察用硬性光学内窥镜产品,即喉镜、鼻窦镜、尿道膀胱镜、宫腔镜、直肠镜。其他第二类硬性光学内窥镜可参考本指导原则适用的内容。
二、技术审查要点
(一)产品名称要求
1.喉镜或喉内窥镜;
2.鼻窦镜或鼻窦内窥镜;
3.尿道膀胱镜、膀胱镜、尿道膀胱内窥镜、膀胱内窥镜;
4.宫腔镜或宫腔内窥镜;
5.直肠镜或直肠内窥镜。
(二)产品的结构和组成
典型产品结构示意图如下:
1.喉镜
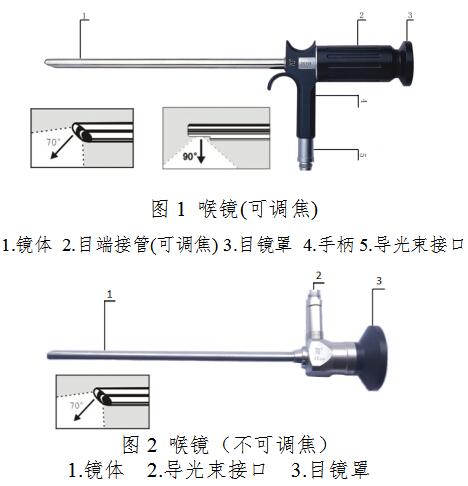
2.鼻窦镜
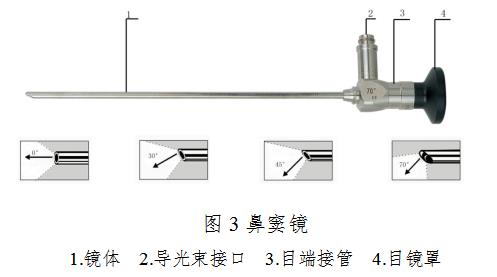
3.尿道膀胱镜
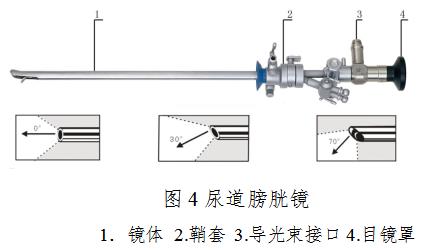
4.宫腔镜
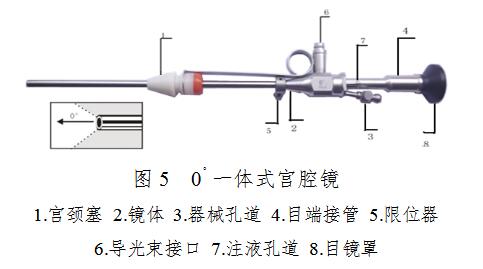

分体式宫腔镜一般由30°宫腔镜(图7所示)、操作器(图8所示)、鞘套(图9所示)等几部分组成。

5.直肠镜

(三)产品工作原理
1.产品的基本原理奇亿娱乐际使用描述
1.1硬性光学内窥镜主要由光学成像系统和照明系统组成。

完整的光学成像系统由物镜系统、传像系统和/或目镜系统三大系统组成。工作原理:被观察物经物镜所成的倒像,通过传像系统将倒像以正像形式传输到目镜,再由目镜放大后,为人眼所观察。为构成不同的视向角,需加入不同的棱镜。不同用途的内窥镜根据使用要求制作成不同的外形、外径、长度,以达到使用所需的要求。
照明传输系统由光导纤维组成。工作原理:将冷光源的光经过光导纤维传输到内窥镜前端,照亮被观察物。
1.2第二类硬性光学内窥镜产品是利用人体自然腔道进入人体观察和诊察,不需切口或打孔穿刺进入人体。尿道膀胱镜、宫腔镜和直肠镜可以利用镜体本身的器械通道(如一体式)或配合使用的附件通道(如分体式)进入活检钳、剪刀、锯齿钳进行活检取样、切割等临床手术;单纯的内窥镜可做检查诊断用(如喉镜、鼻窦镜等)。硬性光学内窥镜的目镜罩除便于人眼直接观察外,通过目镜罩标准尺寸的规定,可与摄像系统连接,通过监视屏显示图像。也存在着无目镜罩的内窥镜,此类内窥镜不能直接目视,必须与摄像系统连接,通过监视屏显示图像。
在操作尿道膀胱镜时,先将鞘套与闭孔器插入尿道及膀胱,退出闭孔器。将内窥镜与镜桥(观察用插管时用插管器)联接插入鞘套后锁紧,进水和出水管联接鞘套水阀上,导光束联接内窥镜上,打开光源及水阀即可进行手术,将异物钳、剪刀、锯齿钳等插入器械通道可进行活检、取样等。
在操作宫腔镜时,先膨胀宫腔,然后将操作鞘套与闭孔器顺宫腔方向插入到宫颈内口稍下方,退出闭孔器,将操作器及内窥镜插入鞘套后锁紧,将输液管联接鞘套水阀上,在80—180mmHg范围的压力下注入5%葡萄糖或0.9%的生理盐水或甘露醇液体以膨宫。待排水孔流出的液体清亮后,在直视下将镜体进一步推进,待宫腔镜充分扩张后即可进行观察子宫异常或病变,若必要时可做相应的内膜活检、输卵管插管注药、分离粘连等手术。
直肠镜可在内窥镜直视下活检取样、切割。
(四)注册单元划分的原则奇亿娱乐例
按照《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)第七十四条要求,“医疗器械产品的注册单元原则上以产品的技术结构、性能指标和预期用途为划分依据”。
一般情况下,仅仅是长度、直径、视向角、视场角、工作通道其中的一个或几个参数有差异,可以作为同一个注册单元,若内窥镜之间的差异超出上述范畴,应考虑应划分为不同的注册单元......
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
奇亿娱乐(中国)有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。