24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
尽管医疗器械的特性要求在一定时间内,医疗器械注册产品和生产要素保持稳定,但科技进步和需求变化无时不刻在催生医疗器械变更需求,今天带大家一起了解进口医疗器械变更注册流程和要求。

进口医疗器械变更注册流程和要求:
已注册的第二类、第三类医疗器械产品,其设计、原材料、生产工艺、适用范围、使用方法等发生实质性变化,有可能影响该医疗器械安全、有效的,注册人应当向原注册部门申请办理变更注册手续;发生其他变化的,应当按照国务院药品监督管理部门的规定备案或者报告。
一、什么情况需要办理进口医疗器械变更注册
1.进口医疗器械注册证载明的产品名称、型号、规格、结构及组成、适用范围、产品技术要求发生变化。
2.进口医疗器械生产地址发生变化。
3.注册证中"其他内容"发生变化。
二、进口医疗器械变更注册流程
产品技术要求、说明书变更——产品检测(NMPA认可的检测机构)——变更注册资料编制——变更注册申请——技术审评——行政许可——取得新的医疗器械产品注册证
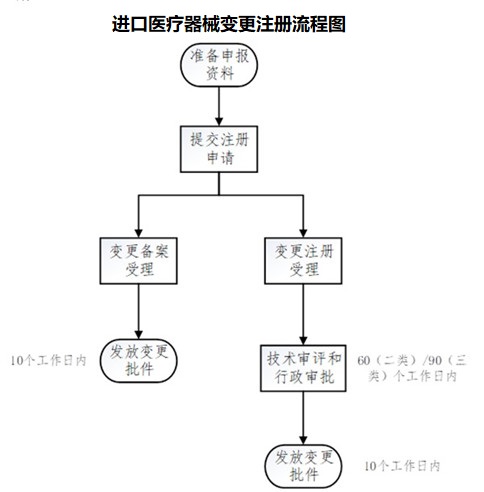
三.进口医疗器械变更注册注意事项
对于线上途径(eRPS系统):变更备案、变更注册申请可在同一申请表申请,合并变更情形仍然按照现行流程分发变更注册受理号,自动关联变更注册电子目录,在进口医疗器械/体外诊断试剂变更注册电子目录的"CH2.7其他申报综述信息"中体现变更备案需提交的资料。
对于线下途径:变更备案、变更注册申请须分别填表,分别准备材料,同时准备符合《关于发布医疗器械注册电子申报目录文件夹结构的通告(2021年第15号)》要求的电子资料。
医疗器械变更注册文件与原医疗器械注册证合并使用,其有效期与原注册证相同。
取得变更注册文件后,注册人应当根据变更内容自行修改产品技术要求、说明书和标签。
发生其他变化的,注册人应当按照质量管理体系要求做好相关工作,并按照规定向药品监督管理部门报告。
任何有关进口医疗器械变更注册流程、进口医疗器械变更注册要多久、进口医疗器械变更注册需要多少钱等相关事项
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
奇亿娱乐(中国)有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。