24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
导言:
《医疗器械监督管理条例》明确了不同医疗器械的管理制度,其中第一类医疗器械实行备案管理,而第二类、第三类医疗器械则需要进行产品注册管理。在这里,我们将深入探讨云南省第二类医疗器械的注册流程、审批时间以及申报资料要求。

一、云南第二类医疗器械注册流程
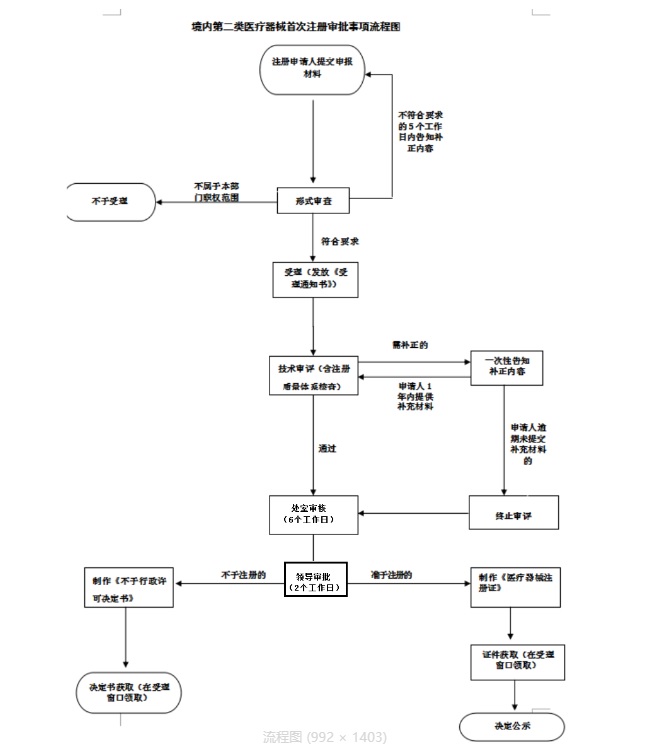
云南省的第二类医疗器械注册流程与其他省市基本保持一致,它包括以下重要步骤:
企业前期准备:
这一阶段包括了厂房装修、工艺布局、设备配置、产品研发定型以及实验室建设等工作。
医疗器械质量管理体系建设:
企业需要建立医疗器械质量管理体系,以确保产品的质量和安全。
产品研发定型:
开展产品研发工作,确保产品达到规定标准。
制造与质量保证能力具备:
生产设施和质量保证体系必须满足相关要求。
医疗器械注册检验:
对产品进行必要的检验和测试。
医疗器械注册申请:
向相应的管理部门提交注册申请。
省药监局技术审评和注册质量管理体系考核:
进行技术审评并核查质量管理体系。
补正:
如有需要,进行注册申请的补正。
获得医疗器械注册证:
审批通过后,获得医疗器械注册证。
申请医疗器械生产许可证:
最终,申请生产许可证以正式生产医疗器械。
药监局医疗器械注册审评审批流程是确保医疗器械质量和安全的重要一环。
二、云南第二类医疗器械注册时间
为提高效率,云南省药监局自2022年起实施了一系列加速医疗器械审批的政策,旨在优化医疗器械注册审评审批流程。尽管不同产品的注册时间会因多种因素而异,但领导层的积极努力、企业的专业度以及第三方医疗器械注册服务机构的支持都有望帮助企业缩短注册时间,提高医疗器械的注册上市效率。
三、云南第二类医疗器械注册申报资料要求
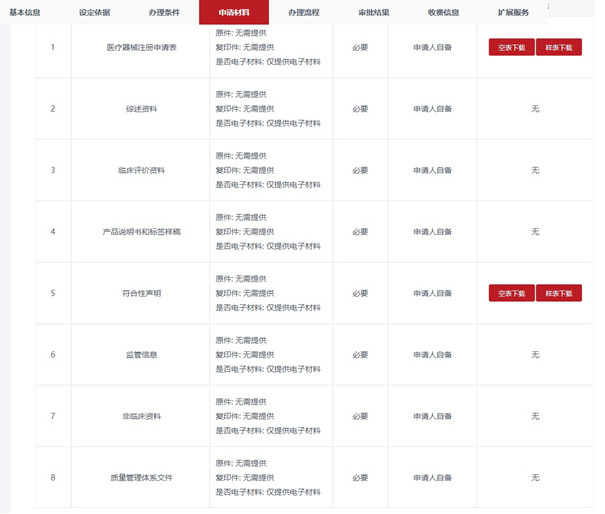
云南省对第二类医疗器械的注册申报资料要求主要包括以下方面:
产品基本信息:
包括产品的名称、型号、用途等。
产品质量和安全性证明:
包括产品的质量检验报告、安全性评估等。
技术文档: 需提供与产品性能和安全相关的技术文档。
生产企业信息:
包括生产企业的资质证明和生产设施信息。
其他必要的法定文件:
包括授权委托书、申请书等。
鉴于国家政策的动态变化,预计云南省的医疗器械注册申报资料要求会逐步与全国趋于一致。
结语:
云南省在医疗器械注册方面采取了一系列措施,旨在提高注册审评效率。企业应当全面了解注册流程和资料要求,以确保医疗器械能够顺利注册上市,为健康事业做出贡献。
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
奇亿娱乐(中国)有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。