24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
在新加坡市场销售您的医疗器械产品之前,您需要在新加坡HSA取得产品的注册。

1、简介
新加坡的医疗器械注册由HSA(Health Sciences Authority )相关部门负责。
当地执行的主要法规为《Health Products Act 2007》,《 Health Products (Medical Devices) Regulations 2010》等。另外作为东盟ASEAN成员国,新加坡也会参考东盟的相关法规。
首先新加坡以外的生产商需要指定授权在新加坡本地的代理公司作为持证人(License Holder),提交注册文件,与当局沟通 ,以及对上市后等活动负责。
注册申请可以在线通过MEDICS(Medical Device Information and Communication System)进行提交。当局批准后,会列入SMDR(Singapore Medical Device Register)数据库。
2、产品风险等级分类
医疗器械的风险分类取决于产品的设计和预期用途。新加坡将医疗器械(包括IVD)根据风险由低至高分为A、B、C、D四类。A类风险最低,D类风险最高。
MD
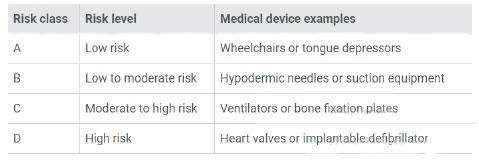
IVD
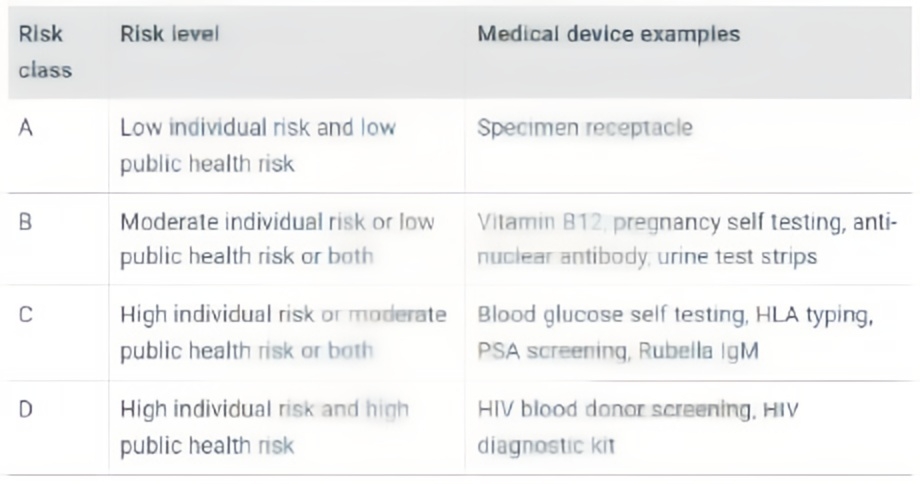
3、注册路径
新加坡当局认可的参考国家(Reference Country)为美国、加拿大、澳大利亚、日本以及欧盟。
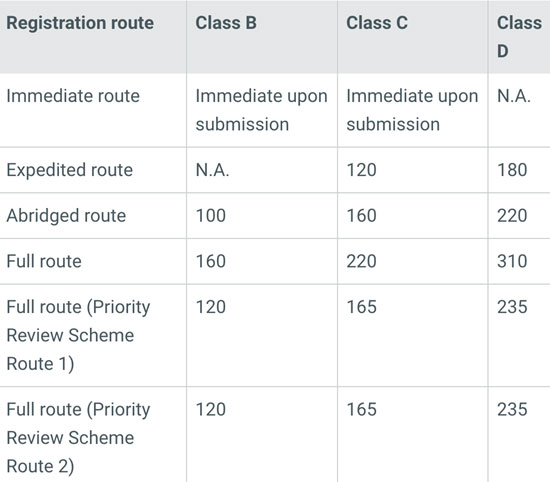
根据产品风险分类以及该产品在参考国家的上市情况,总共有四种不同的注册路径:Immediate、Expedited、Abridged以及Full。总体上来说,同一产品在越多的参考国家获得上市许可,则在新加坡注册的流程越简单快捷。
对于一些创新性产品,在一定条件下新加坡当局也可提供优先个案审核,也会加快约25%的审批时间。

4、技术要求
新加坡当局对于注册技术文件的要求基于东盟ASEAN CSDT(Common Submission Dossier Template),例如符合性声明(Declaration of Conformity)、产品的描述、产品标签、风险分析、临床评价报告(Clinical Evaluation Report)、质量管理体系(QMS)相关文件等。不同风险分类和不同注册路径所需的技术文件不同。
对于质量管理体系,新加坡当局可以接受ISO13485、MDSAP、美国当局的审核(Conformity to US FDA Quality System Regulation)、或日本当局的审核(Japan MHLW Ordinance 169)。
5、官方审批时间
不同分类及不同注册路径所需要的时间及费用不同。例如A类产品可以免予注册,时间最短、费用也最低。而对于高风险产品,注册时间可能需要200-300天,官方费用根据注册的路径不同大约需要1-2万美元。
同一生产商的相同产品、或需要共同使用的产品,可以以Grouping形式提交注册,从而来节约时间和费用成本。
原文来源:嘉峪检测网
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
奇亿娱乐(中国)有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。
上一篇:一文了解我国的医疗器械应急审批