24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
引言:相比于药物临床试验领域有很多成熟经验可以学习、参照,医疗器械临床试验领域还处于起步、探索阶段。临床试验设计及医疗器械临床试验方案对临床评价的合规合法性至关重要,奇亿娱乐为您提供医疗器械临床试验方案范本供您参考(文末有惊喜哦!)。

方案编号:
试验用医疗器械名称:
型号规格:
试验用医疗器械的管理类别:
需进行临床试验审批的第三类医疗器械 是□ 否□
中国境内同类产品 有□ 无□
方案版本号和日期:
临床试验机构:
研究者:
申办者:
代理人:
填写说明:
1. 对于多中心临床试验,封面上的临床试验机构只填写牵头单位,其他机构在方案内容中列出。
2. 对于多中心临床试验,封面上的研究者填写协调研究者。
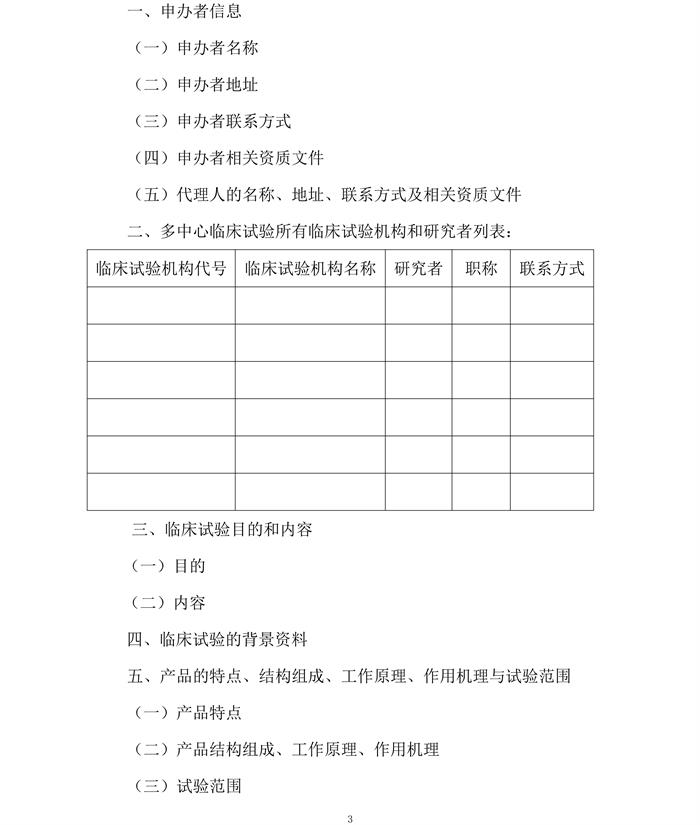
一、申办者信息
(一)申办者名称:
(二)申办者地址:
(三)申办者联系方式:
(四)申办者相关资质文件
(五)代理人的名称、地址、联系方式及相关资质文件
二、多中心临床试验所有临床试验机构和研究者列表:
| 临床试验机构代号 | 临床试验机构名称 | 研究者 | 职称 | 联系方式 |
|---|---|---|---|---|
三、临床试验目的和内容
(一)目的:
验证产品在实际临床使用中,与其他设备误差。
(二)内容
四、临床试验的背景资料
五、产品的特点、结构组成、工作原理、作用机理与试验范围
(一)产品特点
相对于美力顿设备,体积小,具有价格优势
(二)产品结构组成、工作原理、作用机理
(三)试验范围
六、产品的适应症与禁忌症、注意事项
七、总体设计
(一)试验设计
1. 试验目的
2. 试验方法选择及其理由
3. 减少、避免偏倚的措施
4. 试验用医疗器械和对照用医疗器械/ 对照诊疗方法(若有)
5. 受试者选择(包括必要时对照组的选择)
(1)入选标准
(2)排除标准
(3)停止试验/ 试验治疗的标准和程序
(4)入组时间
(5)临床试验的预期总体持续时间及其确定理由
(6)每位受试者的预期参与持续时间
(7)临床试验所需的受试者数量
6. 有效性评价方法
(1)有效性参数的说明
(2)评价、记录和分析有效性参数的方法和时间选择
7. 安全性评价方法
(1)安全性参数的说明
(2)评价、记录和分析安全性参数的方法和时间选择
(二)试验流程
1. 试验流程图
2. 用械规范
(三)监查计划
八、统计学考虑
(一)统计学设计、方法和分析规程
(二)样本量的计算
1. 总样本量
2. 每病种临床试验例数及其确定理由
3. 在多中心临床试验中, 每个临床试验机构的最低和最高的受试者数量及理由
(三)临床试验的显著性水平和把握度
(四)预期脱落率
(五)临床试验结果的合格 / 不合格标准
(六)基于统计学理由终止试验的标准和理由
(七)所有数据的统计方法,连同缺失、未用或错误数据(包括中途退出和撤出)和不合理数据的处理方法
(八)报告偏离原定统计计划的程序
(九)纳入分析中的受试者的选择标准及理由
(十)验证假设时排除特殊信息及其理由(如适用)
九、数据管理
十、可行性分析
(一)成功的可能性分析
(二)失败的可能性分析
十一、临床试验的质量控制
十二、临床试验的伦理问题及知情同意
(一)伦理方面的考虑
(二)试验方案的审批
(三)知情同意过程和知情同意书文本
十三、对不良事件和器械缺陷报告的规定
(一)不良事件
(二)严重不良事件
(三)报告程序、联络人信息
十四、临床试验方案的偏离与临床试验方案修正的规定
十五、直接访问源数据、文件
十六、财务和保险
十七、临床试验报告应涵盖的内容
十八、保密原则
十九、试验结果发表约定
二十、各方承担的职责
研究者声明
我同意:
1. 严格按照赫尔辛基宣言、中国现行法规、以及试验方案的要求进行本次临床试验。
2. 将所要求的全部数据准确记录于病例报告表(CRF)中,按时完成临床试验报告。
3. 试验用医疗器械仅用于本次临床试验,在临床试验过程中完整准确地记录试验用医疗器械的接收和使用情况,并保存记录。
4. 允许申办者授权或派遣的监查员、核查员和监管部门对该项临床试验进行监查、核查和检查。
5. 严格履行各方签署的临床试验合同/ 协议条款。
我已全部阅读了临床试验方案,包括以上的声明,我同意以上全部内容。







站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
奇亿娱乐(中国)有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。