24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

医疗器械临床试验指在国家认可的医疗器械临床试验机构中,拟对申请注册的医疗器械在正常使用条件下的安全性和有效性进行确认或验证的过程。国内医疗器械临床试验起步晚,2004 年前一直处于无章可循的窘态。近年来,国内医疗器械临床试验发展迅速,开展数量增长趋势明显,行业格局也发生了一定的变化。国内医疗器械临床试验目前的现状如何?本文就国内医疗器械临床试验目前的现状进行总结和分析。
1 国内医疗器械临床试验机构备案情况
2017 年 11 月,原国家食品药品监督管理总局会同国家卫生计生委联合发布《医疗器械临床试验机构条件和备案管理办法》。该法规的出台明确了自 2018-01-01 起,医疗器械临床试验必须在经资格认定的医疗器械临床试验机构中开展;2017-01-01~2017-12-31,医疗器械临床试验可继续选择具有资格的药物临床试验机构开展。这也掀起了国内医疗器械临床试验机构备案热潮。
据智械(由南京智械信息科技有限公司开发的一款器械商业信息公开查询系统)数据统计,截至 2018-01-24,全国共有 705 家医疗器械临床试验机构已经备案,2018 年 12 月进入最高峰(该月备案 232 家,占比 32. 9%),2019 年始备案数量开始缩减;不同省份、不同地区的医疗器械临床机构备案分布不均衡,其中广东省机构备案数(73家,占比 10. 4%)位居榜首(见图 1),奇亿娱乐地区机构备案总数最多(该地区备案 248 家,占比 35. 2%)。
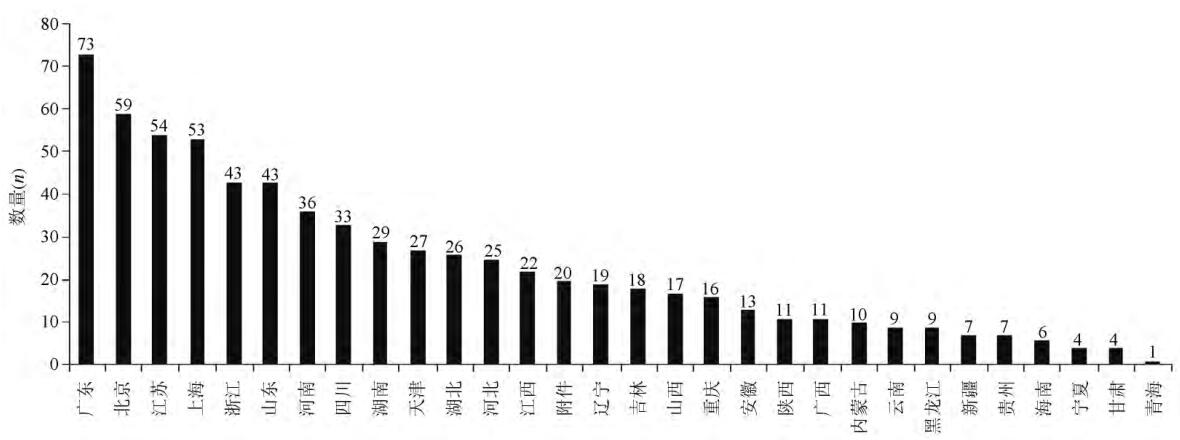
图1 不同省份医疗器械临床试验机构备案分布情况(统计截至 2018-01-24)
Figure 1 The distribution of medical device clinical trial institutions at different provinces in China (By January 24,2019)
2 国内医疗器械临床试验监督和管理情况
2.1 国家法规和行业标准发布情况
截至 2018 年 10 月,国内共发布医疗器械标准1599 项,其中国家标准 219 项(占比 14%),行业标准1380(占比 14%),覆盖医用电气设备、手术器械、外科植入等医疗器械产品等技术领域[1] 。国家药品监督管理局官网数据显示:2014 年至 2018 年发布医疗器械行业标准共计 663 项,医疗器械临床试验主要法规文件共计 10 个,[2017-11-28 发布《医疗器械临床试验检查要点及判定原则》,2017-01-11 发布《接受医疗器械境外临床试验数据技术指导原则》,2017-01-08 发布《医疗器械临床试验设计指导原则》,2016-11-24 发布《医疗器械临床试验机构条件和备案管理办法》,2016-05-11 发布《关于鼓励药品医疗器械创新改革临床试验管理的相关政策》(征求意见稿),2016-02-08 发布《体外诊断试剂注册管理办法》修正案,2015-03-23 发布《医疗器械临床试验质量管理规范》,2013-09-11 发布《体外诊断试剂临床试验技术指导原则》,2013-07-30 发布《医疗器械注册管理办法》,2013-03-07 发布《医疗器械监督管理条例》]。从发布的国家法规和行业标准预测:医疗器械临床试验未来趋于精细化和国际化。
2.2 国家监管部门监督抽查情况
为加强医疗器械临床试验监督管理,2016 年至2018 年原国家食品药物监督管理局每年进行不定期监督抽查,监督抽查情况见表 1。其中 2018 年,第 1批现场检查发现 9 个注册申请项目临床试验存在合规性问题,未发现申请项目临床试验存在真实性问题;第 2 批现场检查发现 2 个注册申请项目临床试验存在真实性问题,2 个注册申请项目临床试验(其中有1 个注册申请项目同时存在真实性问题)存在违反其他临床试验有关规定,不予注册。
此外,2018 年全国部分省市在不同时间也对医疗器械临床试验进行了监督抽查,开展的临床试验监督抽查不仅关注在注册类项目,还包括备案后正处于试验中的项目,监督抽查情况见表 2。从各省市的监督抽查情况通告中可以发现:体外诊断试剂问题较多。
2.3 临床试验机构管理情况
在 2018-01-01 之前,国内医疗器械临床试验基本委托药物临床试验机构开展,实行全程监管 [2](试验前进行试验筹备、项目立项、伦理审查、临床试验协议签署、临床试验启动;试验中进行监查随访、机构质控、跟踪审查;试验后进行研究完成报告和总结报告审查、结题检查、项目核查)。清晰的组织管理......
完整文章免费下载方法:关注底部公众号二维码,公众号内回复“国内医疗器械临床试验现状的分析”即可免费领取文档!
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
奇亿娱乐(中国)有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。