24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
近日有客户咨询到有关医疗器械法规标准体系相关事项,所以,以3D打印椎间融合器这个产品为例,为大家科普医疗器械注册产品适用医疗器械法规标准体系。
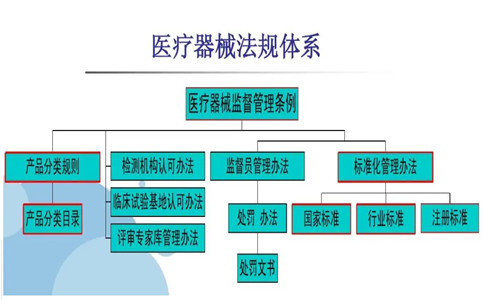
一、产品适用医疗器械法规标准:
3D打印椎间融合器适用医疗器械法规标准。包括但不仅限于以下:
GB/T 228.1金属材料拉伸试验第1部分室温试验方法
GB/T 10610 产品几何技术规范(GPS) 表面结构轮廓法评定表面结构的规则和方法
GB/T 5168 α-β钛合金高低倍组织检验方法
GB/T 4698 (所有部分) 海绵钛、钛及钛合金化学分析方法
GB/T 13810 外科植入物用钛及钛合金加工材
GB/T 33582 机械产品结构有限元力学分析通用原则
YY/T 0316 医疗器械风险管理对医疗器械的应用
YY/T 1427 外科植入物可植入材料及医疗器械静态和动态腐蚀试验的测试溶液和条件
YY/T 1552 外科植入物评价金属植入材料和医疗器械长期腐蚀行为的开路电位测量方法
GB/T 14233.1医用输液、输血、注射器具检验方法第1部分:化学分析方法
GB/T 14233.2医用输液、输血、注射器具检验方法第2部分:生物学试验方法
GB/T 16886.1医疗器械生物学评价第1部分:风险管理过程中的评价与试验
GB/T 35021 增材制造工艺分类及原材料
GB/T 35351 增材制造术语
GB/T 36984外科植入物用多孔金属材料X射线CT检测方法
YY 0341.2 无源外科植入物骨接合与脊柱植入物第2部分:脊柱植入物特殊要求
YY/T 1502 脊柱植入物椎间融合器
YY/T 0343外科金属植入物液体渗透检验
YY/T 0640 无源外科植入物通用要求
YY/T 0466.1 医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求
YY/T 0959 脊柱植入物椎间融合器力学性能试验方法
YY/T 0960 脊柱植入物椎间融合器静态轴向压缩沉陷试验方法
GB 18278系列标准
GB 18279 系列标准
GB 18280 系列标准
WS310.2 《医院消毒供应中心第2部分:清洗消毒及灭菌技术操作规范》
ASTM F2077 Test Methods for Intervertebral Body Fusion Devices
ASTM F2267 Standard Test Method for Measuring Load Induced Subsidence of Intervertebral Body Fusion Device Under Static Axial Compression
ASTM F2119 Standard Test Method for Evaluation of MR Image Artifacts from Passive Implants
ASTM F2182 Standard Test Method for Measurement of Radio Frequency Induced Heating Near Passive Implants During Magnetic Resonance Imaging
ASTM F2213 Standard Test Method for Measurement of Magnetically Induced Torque on Medical Devices in the Magnetic Resonance Environment
ISO 17296-2 Additive manufacturing -- General principles -- Part 2: Overview of process categories and feedstock
ISO 17296-3 Additive manufacturing -- General principles -- Part 3: Main characteristics and corresponding test methods
ISO 17296-4 Additive manufacturing -- General principles -- Part 4: Overview of data processing
ISO 19227 Implants for surgery -- Cleanliness of orthopedic implants -- General requirements
ASTM F3335 Standard Guide for Assessing the Removal of Additive Manufacturing Residues in Medical Devices Fabricated by Powder Bed Fusion ASTM F3122 Standard Guide for Evaluating Mechanical Properties of Metal Materials Made via additive manufacturing process
ISO/ASTM 52921 Standard terminology for additive manufacturing -- Coordinate systems and test methodologies
ISO/ASTM52915 Specification for additive manufacturing file format (AMF) Version 1.2
ISO/ASTM 52901 Additive manufacturing -- General principles -- Requirements for purchased AM parts
ISO/ASTM 52900 Additive manufacturing -- General principles – Terminology
ISO/ASTM 52910 Additive manufacturing -- Design -- Requirements, guidelines and recommendations
ASTM F2924 Standard Specification for Additive Manufacturing Titanium-6 Aluminum-4 Vanadium with Powder Bed Fusion
ASTM F3001 Standard Specification for Additive Manufacturing Titanium-6 Aluminum-4 Vanadium ELI (Extra Low Interstitial) with Powder Bed Fusion
ASTM F3049 Standard Guide for Characterizing Properties of Metal Powders Used for Additive Manufacturing Processes
二、产品适用的医疗器械注册技术审评指导原则:
《医疗器械注册单元划分指导原则》
《椎间融合器注册技术审查指导原则》
《无源植入性医疗器械货架有效期注册申报资料指导原则(2017年修订版)》
《医疗器械动物试验研究注册审查指导原则第一部分:决策原则(2021年修订版)》
《医疗器械动物试验研究注册审查指导原则第二部分:试验设计、实施质量保证》
《医疗器械临床评价技术指导原则》
《接受医疗器械境外临床试验数据技术指导原则》
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
奇亿娱乐(中国)有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。