24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
应用纳米材料的医疗器械安全性和有效性评价指导原则第二部分:理化表征
本指导原则为注册申请人/监管人员提供关于应用纳米材料的医疗器械理化表征相关方面的信息。
本指导原则是对应用纳米材料医疗器械理化表征的一般要求,医疗器械注册申请人应依据具体产品的特性对注册申报资料的内容进行充分说明和细化。注册申请人还应依据具体产品的特性确定其中的相关内容是否适用,若不适用,需详细阐述理由及相应的科学依据。
本指导原则是对医疗器械注册申请人和审评人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能满足相关法规要求的其它方法,也可以采用,但是需要提供详细的研究资料和验证资料。应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将进行适时的调整。
一、适用范围
本指导原则适用于与人体直接或间接接触,由纳米材料组成或包含纳米材料的医疗器械的理化表征。
不适用于:
- 应用纳米材料的体外诊断产品;
- 应用纳米材料的药品;
- 纳米技术赋能的医疗产品(如纳米机器人);
- 应用纳米材料的医疗器械在制造和废弃过程中造成的职业和环境风险。
二、理化表征在应用纳米材料的医疗器械申报资料中的体现
应用纳米材料的医疗器械产品的安全性和有效性与所使用的纳米材料的理化性质(如化学组成、尺寸及尺寸分布、形态学、表面特性等)紧密相关。根据国家药品监督管理局发布的《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》,理化表征在应用纳米材料的医疗器械产品安全性和有效性评价的意义和作用主要体现在以下申报资料中:
(一)监管信息(委托信息、主文档授权信)
应用纳米材料的医疗器械产品注册申请人可自行独立研发、或委托第三方研发纳米原材料,或直接外购纳米原材料。注册申请人应具备对于纳米原材料的完整评价和供应商审核能力,并证明其对医疗器械终产品生产关键工艺及参数进行质量控制的能力。因此,如果医疗器械的原材料为纳米材料,注册申请人应提供包括纳米原材料的理化表征在内的质量控制文件。如果委托其他企业生产的,应当提供受托企业资格文件、委托合同和质量协议。在质量协议中,应提供纳米材料质量控制相关参数。如果原材料供应商已在国家药品监督管理局医疗器械技术审评中心进行过主文档备案,应提交主文档授权信。
(二)研究资料(产品化学和物理性能研究)
注册申请人在设计应用纳米材料的医疗器械时,预期利用纳米材料的某些特殊性能,如小尺寸、高比表面积、高化学活性,或者利用纳米表面特性对于体内微环境的影响来发挥其功能。如纳米银敷料利用了纳米银在一定时期内可持续释放银的特性。又如某些骨科植入物表面纳米结构的设计,可以促进骨重建过程。为证明产品中所设计应用的纳米材料能够发挥预期特性,注册申请人需开展有针对性的理化性质表征。这些研究也将成为确定产品技术要求中科学合理的性能指标和检验方法的关键依据。
(三)研究资料(产品生物学特性研究)
现行的GB/T 16886.1(ISO 10993.1)将理化表征作为医疗器械生物相容性评价的起点。对于应用纳米材料的医疗器械,这一点尤为重要,因纳米材料的生物学效应取决于其理化性质,如尺寸及尺寸分布、形态学、表面特性、化学组成、团聚/聚集状态等。在生物相容性/毒理学研究过程中,注册申请人不仅要对医疗器械产品中的纳米材料开展理化表征,而且根据风险分析,确定是否需要针对在生物组织/体液中的纳米材料及其代谢/转归产物开展理化表征。客观、真实的定性/定量理化表征结果,可为开展生物相容性/毒理学研究提供必要的信息。相反,非客观、真实的定性/定量理化表征结果,可能导致对于产品安全性风险的错误判定。
(四)研究资料(清洁、消毒、灭菌研究)
在应用纳米材料的医疗器械生产工艺过程中,作为原材料之一的纳米材料通常经过多道工艺过程,生产工艺过程对于终产品中纳米材料存在状态的影响,以及产品的批间/批内稳定性和均一性需要通过充分的理化表征来证明。
建议注册申请人在灭菌方法验证中对于纳米材料特性加以考虑,如:辐照剂量对于纳米材料是否存在影响,环氧乙烷是否会残留在纳米材料结构中难以解析等。此外,注册申请人在考虑对于验证所需产品批次和样本量的要求时,也需要通过理化表征对于纳米材料在医疗器械中分布的均匀性等因素进行研究分析。
(五)研究资料(稳定性研究)
理化表征同样对于产品货架有效期和包装验证非常重要。目前,产品有效期验证所采用的加速老化计算依据仍是根据传统高分子材料总结的阿累尼乌斯(Arrhenius)反应公式,该公式是否适用于纳米材料仍有待深入研究。因此,建议注册申请人在有效期各时间点应针对纳米材料开展适宜的理化表征,以证明医疗器械中的纳米材料是否在储存期内发生物理性质和化学性质的变化。
(六)产品临床评价资料
目前,应用纳米材料的医疗器械临床评价尚缺乏相应的指导原则/审评要点。注册申请人应根据申报产品的适用范围、技术特征、已有临床数据等具体情况,选择恰当的临床评价路径,包括“同品种临床评价路径”和/或“临床试验路径”。若注册申请人通过同品种临床评价路径进行临床评价,除了提交申报产品与同品种医疗器械在适用范围、技术特征、生物学特性方面的对比资料,注册申请人还需开展具有针对性和特异性的完整而全面的理化表征研究,这对于确定对照产品是否为同品种产品是至关重要的。
三、纳米材料理化性质表征的基本原则
纳米材料尺寸小、比表面积大、化学活性高,在不同环境中表面特性和聚集状态易发生变化,这给纳米材料的生物学效应评估带来挑战。针对应用纳米材料的医疗器械开展全面而准确的理化性质表征以及使用过程中纳米材料理化性质变化测量都至关重要。应用纳米材料的医疗器械的理化表征流程图可以参考图1a。根据产品及纳米材料的性质,可以选择不同阶段的理化检测项目,流程图1b中给出了检测项目示例。该理化表征可分为三个层次:纳米原材料、医疗器械终产品中的纳米材料、生物组织样本中的纳米材料(仅适用于生物组织吸收了应用纳米材料的医疗器械释放的纳米材料;或者应用纳米材料的医疗器械中的纳米材料释放并迁移到了生物组织样本中)。
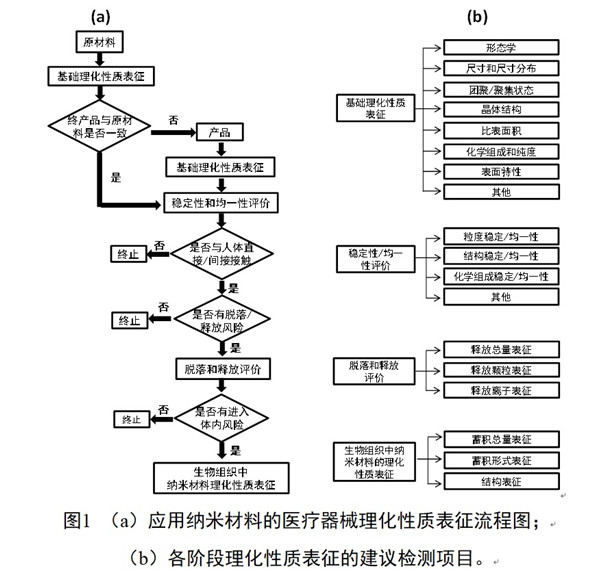
开展应用纳米材料医疗器械理化表征的第一步是对作为医疗器械生产的起始纳米原材料和终产品中的纳米材料进行理化表征,包括形态学、尺寸、团聚/聚集状态、晶体结构、比表面积、化学组成与纯度、表面特性等。通过同时表征的数据证明起始原料的表征数据与终产品中应用的纳米材料是否相同。如果相同或者有数据阐明相似的材料具有足够相似的理化性质,可以考虑采用这些数据来进行产品的风险评估。如果不同,则应以终产品的详细表征数据为基础进行风险评估。为了确保在同一工艺参数下,产品的质量差异在可接受的偏差范围内,注册申请人需对产品中的纳米材料进行明确的稳定性和均一性评价。评价内容包括储存、运输、使用等过程中,纳米材料受环境等因素影响,随时间推移造成的几何形态学、尺寸、聚集状态、化学成分、氧化状态等理化性质的变化。
需要强调的是,纳米材料可能在加工过程中改变其表面化学,比如获得新的或额外的表面分子,作用类似于涂层;或者氧化状态改变等。鉴于这些潜在的表面改变,如有必要,注册申请人应考虑纳米材料在测试和/或使用的不同阶段开展理化性质表征。
对于与人体有直接或间接接触的医疗器械,纳米材料的脱落和释放风险是必须要考虑的。游离的纳米材料或释放的离子进入体内是可能引起在个体水平、组织水平以及细胞和分子水平上不良反应的关键因素。因此需要根据纳米材料脱落/释放的风险评估,对可能暴露的纳米材料进行分析与理化表征,包括测量释放元素的种类与释放元素总量,以及测量释放液中可能存在的纳米颗粒以及离子浓度。需要指出的是:纳米材料的脱落和释放评价不仅限于体外评价,如适用,鼓励注册申请人同时开展体外和体内纳米材料脱落和释放评价研究,并将体外和体内研究结果相关联。
产品使用过程中脱落或释放的纳米材料,以及由纳米材料释放的离子可随血液系统或淋巴系统进入体内循环,并在组织器官中蓄积。纳米材料在生物组织中的蓄积量、存在形式(颗粒或其降解产物)以及材料结构是否出现缺陷决定了其在体内的稳定性和潜在的生物安全性。因而如果从产品中脱落/释放的纳米材料有进入体内循环系统的风险,则有必要提供生物组织中纳米材料的蓄积量数据,并证实其存在形式、结构等理化性质。
如本指导原则第二部分所述,在原材料质控、产品有效性研究、产品安全性研究、产品生产工艺和质量控制研究,以及产品临床评价中,需要针对不同样本中的纳米材料进行适宜的理化表征。注册申请人、科研人员、检测人员,以及审评人员应当认识到,只有采用适合产品特点,并能最大限度保持或模拟产品与人体接触暴露环境的理化表征手段,且试验人员和评价人员具备足够的纳米材料相关知识的前提下,理化表征结果才能用于正确评价应用纳米材料的医疗器械安全性和有效性。
例如,在开展纳米银敷料类产品理化表征时,应在总银含量和可溶性银含量的测定研究中,正确区分离子形式的银和纳米颗粒状态的银,同时需要区分银的价态。目前,测定总银含量的主流方法是经硝酸消解后采用ICP-MS方法分析。注册申请人应考虑将经验证的单颗粒ICP-MS、同步辐射方法、光电子能谱(XPS)、高光谱成像方法等,用于实际纳米银敷料产品的研究,以便区分释放的银是离子状态还是颗粒状态,以及银的价态,同时借助原位、无损、高灵敏度的分析方法来明确生物转运过程中银的化学性质转化,探讨生物体银的化学性质信息与生物效应的关系。
前期研究工作已证实纳米材料有可能与蛋白质相互作用,形成蛋白冠,影响纳米颗粒的各种生物学效应。在银的释放试验中,如果仅采用简单体外模型,例如采用不含蛋白的纯水、PBS或生理盐水研究银的释放/溶出,则无法反映临床使用中实际创面及其渗出液存在蛋白或其他成分的复杂情况,特别是形成蛋白冠现象,应考虑这一因素对于产品中银的释放/溶出,以及进入体内的行为和生物学效应的影响。
应用纳米材料的医疗器械理化表征和测量方法示例见附件1的表1,该表内容主要来源于GB/T 39261(ISO/TR 13014),以及ISO/TR 10993.22。注册申请人应根据产品及纳米材料特性选择适合的理化表征方法组合。此外,如有必要,注册申请人也应提供该表之外检测方法获得的额外信息以便进行风险评估。需要指出的是,当前大多数纳米材料理化表征方法是针对科研或工业中应用的纳米材料制订的,并未采用实际医疗器械产品进行过纳米材料表征或者生物样本中纳米材料表征的验证和优化。因此,注册申请人在采用相关标准方法开展理化表征研究时,需对所采用的方法是否适用于应用纳米材料的医疗器械进行验证,充分考虑所采用的方法中不适用部分的改进和优化。
四、现行可用标准简介
目前,针对纳米材料或纳米技术的国内标准(包括国家标准、行业标准、地方标准、团体标准)有近200个。其中涉及理化表征的技术方法类或指南类标准约有100个,均可选择性地被用于应用纳米材料的医疗器械理化表征检测。另外,还有很多并非针对纳米材料或纳米技术的方法标准也可用于应用纳米材料的医疗器械理化表征检测。附件1的表1中尽可能收集了纳米材料理化表征相关的标准。但注册申请人、检测机构,以及审评部门应根据应用纳米材料的医疗器械预期用途、结构组成、作用机理、与人体的暴露途径/时间、纳米材料在医疗器械中的存在形式等因素,综合考虑上述标准是否适用于医疗器械中的纳米材料表征。
目前,国家药监局已发布了三项专门针对应用纳米材料的医疗器械行业标准,分别是YY/T 1295《医疗器械生物学评价 纳米材料:细菌内毒素试验》、YY/T 0993《医疗器械生物学评价 纳米材料:体外细胞毒性试验(MTT试验和LDH试验)》,以及YY/T 1532《医疗器械生物学评价 纳米材料 溶血试验》,其中都涉及到对于纳米材料理化表征的相关要求。YY/T 1863《纳米医疗器械生物学评价 含纳米银敷料中银颗粒和银离子的释放与表征方法》行业标准即将发布,该标准给出了具体的释放试验方法与表征方法。
此外,已发布的GB/T 38261《纳米技术 生物样品中银含量测量 电感耦合等离子体质谱法》标准适用于各种生物组织中银含量的定量测量。
五、缩略语和术语表
缩略语/术语 | 英文全称 | 解释 |
AES | auger electron spectroscopy | 俄歇电子能谱法 |
AFM | atomic force microscopy | 原子力显微镜法 |
AUC | analytical ultracentrifugation | 分析型超速离心 |
BET | Brunner?Emmet?Teller method | 比表面积测量:旨在解释气体分子在固体表面的物理吸附的布鲁诺-艾默特-泰勒(BET)理论 |
CLS | centrifugal liquid sedimentation | 液体离心沉降 |
DLS | dynamic light scattering | 动态光散射是在一个系综中测量颗粒粒径分布的方法 |
DMA | differential mobility analysis | 微分迁移率分析 |
EDS | energy dispersive X-ray spectroscopy | 能量色散X射线光谱,可分析小至几纳米直径的颗粒 |
EELS | electron energy loss spectroscopy | 电子能量损失谱,可分析小至几纳米直径的颗粒 |
EFSA | European Food Safety Authority | 欧洲食品安全局 |
ESEM | environmental scanning electron microscopy | 环境扫描电子显微镜法 |
FTIR | Fourier transform infrared spectroscopy | 傅里叶变换红外光谱法 |
IR | infrared absorption spectrum | 红外吸收光谱 |
ICP-MS | inductively coupled plasma mass spectrometry | 电感耦合等离子体质谱法 |
ICP-OES | inductively coupled plasma-optical emission spectrometry | 电感耦合等离子体发射光谱法 |
LII | laser induced incandescence | 激光诱导白炽光 |
MFS | molecular fluorescence spectroscopy | 分子荧光光谱 |
MS | mass spectrometry | 质谱法 |
NMR | nuclear magnetic resonance | 核磁共振 |
PTA | particle tracking analysis | 颗粒跟踪分析 |
SAXS | small angle X-ray scattering | 小角X射线散射 |
SCCS | Scientific Committee on Consumer Safety | 消费者安全科学委员会 |
SEC | size exclusion chromatography | 尺寸排阻色谱 |
SEM | scanning electron microscope | 扫描电子显微镜法 |
SIMS | secondary ion mass spectrometry | 二次离子质谱法 |
spICP-MS | single particle inductively coupled plasma mass spectrometry | 单颗粒电感耦合等离子体质谱法 |
SPM | scanning probe microscopy | 扫描探针显微镜法 |
STM | scanning tunneling microscopy | 扫描隧道显微镜法 |
TEM | transmission electron microscopy | 透射电子显微镜法 |
TG | thermogravimetric analysis | 热重分析 |
USAXS | ultrasmall angle X-ray scattering | 超小角X射线散射 |
UV-Vis | ultraviolet–visible spectroscopy | 紫外可见光谱 |
XPS | X-ray photoemission spectroscopy | X射线光电子能谱,也称为ESCA |
XRD | X-ray diffraction | X射线衍射 |
XRF | X-ray fluorescence spectrometry | X射线荧光光谱 |
XAFS | X-ray absorption fine structure | X射线吸收精细结构谱 |
纳米物体 | nano-object | 一维、二维或奇亿娱乐外部维度处于纳米尺度的物体。注:用于所有相互分离的纳米尺度物体的通用术语。(GB/T 30544.1) |
纳米颗粒 | nanoparticle | 三个维度的外部尺寸都在纳米尺度的纳米物体,其最长轴和最短轴的长度没有明显差别。注:如果纳米物体最长轴和最短轴的长度差别显著(大于3倍)时,应用纳米棒、纳米纤维或纳米片来表示纳米颗粒。(GB/T 32269-2015) |
纳米尺度 | nanoscale | 处于1 nm至100 nm之间的尺寸范围(GB/T 30544.1) |
纳米结构材料 | nanostructure material | 内部或表面具有纳米结构的材料。(GB/T 30544.1) |
六、参考文献
[1]GB/Z 16886.22-2022(ISO/TR 10993.22:2017,IDT),医疗器械生物学评价-第22部分:纳米材料指南[S].
[2]GB/T 39261-2020,纳米技术 纳米材料毒理学评价前理化性质表征指南[S].
[3]国家药品监督管理局.医疗器械注册申报资料要求和批准证明文件格式:国家局公告2021年第121号[Z].
[4]GB/T 38261-2019,纳米技术 生物样品中银含量测量 电感耦合等离子体质谱法[S].
[5]ISO/TR 13014:2012,纳米技术——工程纳米材料理化特性毒理学评估指南Nanotechnologies-Guidance on physico-chemical characterization of engineered nanoscale materials for toxicologic assessment[S].
[6]GB/T 21649.1-2008,粒度分析 图像分析法 第1部分:静态图像分析法[S].
[7]GB/T 15445.6-2014,粒度分析 结果的表述 第6部分:颗粒形状和形态的定性及定量表述[S].
[8]GB/T 27788-2020,微束分析 扫描电镜 图像放大倍率校准导则[S].
[9]ISO 21363:2020, Nanotechnologies - Measurements of particle size and shape distributions by transmission electron microscopy[S].
[10]ISO 19749:2021, Nanotechnologies - Measurements of particle size and shape distributions by scanning electron microscopy[S].
[11]JY/T 0582-2020,扫描探针显微镜分析方法通则[S].
[12]ISO/TS 19590:2019, Nanotechnologies - Size distribution and concentration of inorganic nanoparticles in aqueous media via single particle inductively coupled plasma mass spectrometry[S].
[13]GB/T 29022-2021,粒度分析 动态光散射法(DLS)[S].
[14]GB/T 19627-2005,粒度分析 光子相关光谱法[S].
[15]GB/T 20307-2006,纳米级长度的扫描电镜测量方法通则[S].
[16]GB/T 30543-2014,纳米技术 单壁碳纳米管的透射电子显微术表征方法[S].
[17]ISO 19430:2016, Particle size analysis Particle tracking analysis (PTA) method[S].
[18]ISO 13318, Determination of particle size distribution by centrifugal liquid sedimentation methods系列标准[S].
[19]GB/T 19077-2016,粒度分析 激光衍射法[S].
[20]GB/T 32871-2016,单壁碳纳米管表征 拉曼光谱法[S].
[21]GB/T 29024,粒度分析 单颗粒的光学测量方法 系列标准[S].
[22]GB/T 41316-2022,分散体系稳定性表征指导原则[S].
[23]GB/T 38431-2019,颗粒分散体系稳定性评价 静态多重光散射法[S].
[24]GB/T 19587-2017,气体吸附BET法测定固态物质比表面积[S].
[25]GB/T 39713-2020,精细陶瓷粉体比表面积试验方法 气体吸附BET法[S].
[26]GB/T 21650,压汞法和气体吸附法测定固体材料孔径分布和孔隙度 系列标准[S].
[27]GB/T 17359-2012,微束分析 能谱法定量分析[S].
[28]GB/T 30703-2014,微束分析 电子背散射衍射取向分析方法导则[S].
[29]GB/T 28634-2012,微束分析 电子探针显微分析 块状试样波谱法定量点分析[S].
[30]GB/T 25189-2010,微束分析 扫描电镜能谱仪定量分析参数的测定方法[S].
[31]GB/T 30543-2014,纳米技术 单壁碳纳米管的透射电子显微术表征方法[S].
[32]GB/T 36065-2018,纳米技术 碳纳米管无定形碳、灰分和挥发物的分析 热重法[S].
[33]GB/T 30903-2014,无机化工产品 杂质元素的测定 电感耦合等离子体质谱法(ICP-MS)[S].
[34]GB/T 38261-2019,纳米技术 生物样品中银含量测量[S].
[35]GB/T 38789-2020,口腔清洁护理用品 牙膏中10种元素含量的测定 电感耦合等离子体质谱法[S].
[36]GB/T 25185-2010,表面化学分析 X射线光电子能谱 荷电控制和荷电校正方法的报告[S].
[37]GB/T 26533-2011,俄歇电子能谱分析方法通则[S].
[38]GB/T 29558-2013,表面化学分析 俄歇电子能谱 强度标的重复性和一致性[S].
[39]GB/T 29556-2013,表面化学分析 俄歇电子能谱和X射线光电子能谱 横向分辨率、分析面积和分析器所能检测到的样品面积的测定[S].
[40]GB/T 30702-2014,表面化学分析 俄歇电子能谱和X射线光电子能谱 实验测定的相对灵敏度因子在均匀材料定量分析中的使用指南[S].
[41]GB/T 28893-2012,表面化学分析 俄歇电子能谱和X射线光电子能谱 测定峰强度的方法和报告结果所需的信息[S].
[42]GB/Z 32494-2016,表面化学分析 俄歇电子能谱 化学信息的解析[S].
[43]GB/T 24581-2022,硅单晶中III、V族杂质含量的测定 低温傅立叶变换红外光谱法[S].
[44]GB/T 39114-2020,纳米技术 单壁碳纳米管的紫外/可见/近红外吸收光谱表征方法[S].
[45]JY/T 022-1996,紫外和可见吸收光谱方法通则[S].
[46]GB/T 19502-2004,表面化学分析 辉光放电发射光谱方法通则[S].
[47]GB/T 30902-2014,无机化工产品 杂质元素的测定 电感耦合等离子体发射光谱法(ICP-OES)[S].
[48]GB/T 33324-2016,胶乳制品中重金属含量的测定 电感耦合等离子体原子发射光谱法[S].
[49]GB/T 30905-2014,无机化工产品 元素含量的测定 X射线荧光光谱法[S].
[50]JY/T 0573-2020,激光拉曼光谱分析方法通则[S].
[51]GB/T 29858-2013,分子光谱多元校正定量分析通则[S].
[52]JY/T 0578-2020,超导脉冲傅里叶变换核磁共振波谱测试方法通则[S].
[53]DB46/T 520-2020,全生物降解塑料制品 核磁共振波谱快速检测法[S].
[54]GB/T 33523-2017,产品几何技术规范(GPS) 表面结构 区域法 系列标准[S].
[55]GB/T 33498-2017,表面化学分析 纳米结构材料表征[S].
[56]GB/T 28894-2012,表面化学分析 分析前样品的处理[S].
[57]GB/T 40109-2021,表面化学分析 二次离子质谱 硅中硼深度剖析方法[S].
[58]GB/T 25186-2010,表面化学分析 二次离子质谱 - 由离子注入参考物质确定相对灵敏度因子[S].
[59]GB/T 32671,胶体体系 zeta电位测量方法 系列标准[S].
[60]GB/T 41316-2022,分散体系稳定性表征指导原则[S].
[61]GB/T 38431-2019,颗粒 分散体系稳定性评价 静态多重光散射法[S].
[62]欧盟奇亿娱乐与新识别健康风险委员会(SCENIHR),医疗器械中应用的纳米材料潜在健康效应指导原则 Guidance on the Determination of Potential Health Effects of Nanomaterials Used in Medical Devices,Scientific Committee on Emerging and Newly Identified Health Risks[Z]. 2015
[63]THE U.S. FOOD AND DRUG ADMINISTRATION. Nanotechnology—Over a Decade of Progress and Innovation, 2020[R].
[64]G.A.Martínez-Castaón, F.Martínez-Gutiérrez, F.Ruiz, et al. Characterization and biocompatibility of chitosan gels with silver and gold nanoparticles[J]. J Nanomater, 2014, 543419.
[65]Harada Masafumi, Yamamoto Miho, Iwase Hiroki. Combined small-angle neutron scattering/small-angle X?ray scattering analysis for the characterization of silver nanoparticles prepared via photoreduction in water-in-oil microemulsions[J]. Langmuir 2021, 37:13085?13098.
[66]J Liu,KE Murphy,RI Maccuspie, et al. Capabilities of single particle inductively coupled plasma mass spectrometry for the size measurement of nanoparticles: a case study on gold nanoparticles[J]. Anal. Chem. 2014, 86:3405–3414.
[67]DE Gorka, NJ Lin, JM Pettibone, et al. Chemical and physical transformations of silver nanomaterial containing textiles after modeled human exposure[J]. NanoImpact. 2019, 14C:100160.
[68]Wang Liming, Zhang Tianlu Li Panyun, et al. Use of Synchrotron Radiation-Analytical Techniques To Reveal Chemical Origin of Silver-Nanoparticle Cytotoxicity[J]. ACS Nano 2015, 9:6532-6547.
[69]YY/T 1295-2015,医疗器械生物学评价 纳米材料:细菌内毒素试验[S].
[70]YY/T 0993-2015,医疗器械生物学评价 纳米材料:体外细胞毒性试验(MTT试验和LDH试验)[S].
[71]YY/T 1532-2017,医疗器械生物学评价 纳米材料 溶血试验[S].
[72]YY/T 1863-2023,纳米医疗器械生物学评价 含纳米银敷料中银颗粒和银离子的释放与表征方法[S].
七、编写单位
本指导原则由国家药品监督管理局医疗器械技术审评中心牵头,国家纳米科学中心、中国食品药品检定研究院参与编写,由国家药品监督管理局医疗器械技术审评中心负责解释。
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
奇亿娱乐(中国)有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。