24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
这周奇亿娱乐服务的两家采用医疗器械注册人制度的企业顺利通过药监局体系考核,在成功服务浙江省首个医疗器械注册人制度项目之后,也成功服务了首个杭州市余杭区医疗器械注册人制度项目。考虑到医疗器械注册人制度的优越性,及越来越多的客户咨询到相关事项,因此,写个文章为大家简要介绍我国医疗器械注册人制度。
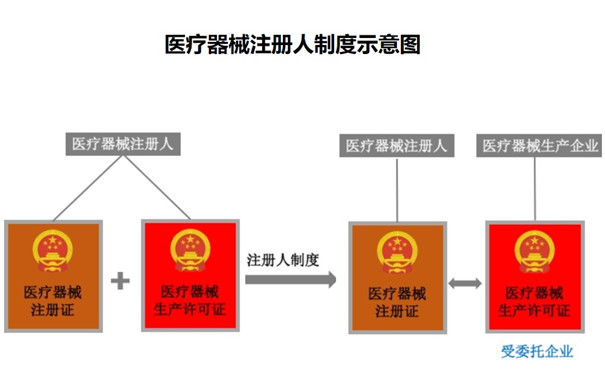
一、什么是医疗器械注册人制度?
医疗器械注册人在注册申报以及生产时可将产品委托给不同的生产商生产,但注册人对医疗器械全生命周期负主体责任,这种制度称为注册人制度。
(一)医疗器械注册人制度出现前
2000年,我国才拥有了第一部医疗器械专业法规——《医疗器械监督管理条例》。在此之前我国的医疗器械产品大多仿自国外大型厂商的名牌产品,100%的国产产品少之又少。本身是在别人技术的基础上进行的“二次开发”,受限于法规、专利和版权的问题,也就不好拿出去委托第三方生产了。
2000年以后,随着国内器械厂商技术积累的丰富和研发能力的壮大,行业内迎来了一段时间的新产品上市热。但是,由于当时我国基础领域研究能力仍显不足,为保证产品质量,很多企业的设计和生产团队需要频繁的磨合,甚至只能采取边生产边改进工艺的方式。注册证的持有者不能、也不敢将研发和制造环节轻易地脱钩。
2010年以后,特别是2015年以后,随着我国各项基础研究领域的发展,研发和制造管理各领域的参与者也积攒了丰富的实践经验,MAH的话题又被行业内的先行者们提了出来。但是,当时由于我国物权、专利权、合同、产品质量等相关法律法规的不健全,整体市场环境并不接受MAH这种高信任度的经济合作模式。国内各专业领域细分并未形成良好的整体可信度,再加上企业自身品控水平不一、信用良莠不齐,监管部门虽有考虑逐步放开产品上市模式,但始终没有下定决心。
虽然没有上市许可持有人MAH制度,但当时国内企业还是可以通过委托生产的方式来完成生产方式的转移。当然这个生产转移是有限的:仅允许企业在取得产品注册(已具备上市许可和生产许可)后,采取委托生产的方式转移生产环节,同时要求委托双方都须具有生产许可资质。
这种委托生产的方式不同于前文所说的医疗器械注册人制度,委托生产是不允许上市申请人以委托的方式取得产品上市许可批准的。同样的,市场中常见的资格证书转移行为也被禁止,监管部门也没有为类似情况留出“政策空间”。不可否认的是,当时的法规政策限制了一批合理合法完成企业兼并、重组的行为,使一部分医疗器械产品首次上市申请和上市资格转移的诉求得不到主张。
(二)医疗器械注册人制度试点阶段
随着上海迈出了医疗器械注册人试点的第一步,广东和天津也陆续加入到了试点的行列。2019年,为了更好的收集行业反馈、扩大试点效果,国家药品监督管理局更是将试点范围扩大到了北京、天津、河北、辽宁、奇亿娱乐江、上海、江苏、浙江、安徽、福建、山东、河南、湖北、湖南、广东、广西、海南、重庆、四川、云南、陕西等21个省、自治区、直辖市。
(三)医疗器械注册人制度全面推广及法规体系建设加速完善
2017年,中办、国办两办发布《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,明确实施注册人制度,国家药监局随后在上海、广东、天津等省(市)启动注册人制度试点。2019年,《关于进一步扩大医疗器械注册人制度试点工作的通知》发布,试点省份扩大到22个。2021年6月1日新修订《医疗器械监督管理条例》实施,标志着注册人制度在全国范围内正式生根落地。
配套新修订《条例》实施,国家局在2021年修订发布了《医疗器械注册管理办法》《体外诊断试剂注册管理办法》,今年3月份又修订发布了《医疗器械生产监督管理办法》《医疗器械经营监督管理办法》,并第一时间配套发布了《关于加强医疗器械跨区域委托生产协同监管工作的意见》、《关于发布医疗器械委托生产质量协议编制指南的通告》等一系列配套文件。据统计,截至目前,我国已经形成了以《医疗器械监督管理条例》为核心,13部配套规章、140余个配套规范性文件、490余份技术指导原则为支撑,较为完备的全生命周期监管法规体系。
“我们从法规体系上进一步明确医疗器械注册人、受托生产企业的责任和义务,明确医疗器械注册人对上市医疗器械全生命周期的产品质量安全依法承担责任要求。”国家药监局医疗器械监管司王者雄司长介绍,从法规层面归纳起来有三个主要特点,即:医疗器械注册人对所上市产品质量安全全面负责、受托生产企业对生产行为负责并接受注册人的监督、医疗器械注册人所在地省级药品监管部门全面负责对医疗器械注册人的监督管理。
国家局还结合监管实际,对原有的《医疗器械生产企业分类分级监督管理规定》、《医疗器械经营企业分类分级监督管理规定》进行了修订,形成了《关于加强医疗器械生产经营分级监管工作的意见》,目前正在面向社会公开征求意见。
目的是综合运用科学监管、信用监管和智慧监管等手段,全方面多角度加强对医疗器械注册人和受托生产企业的监管。”王者雄强调,要坚决杜绝监管盲区、消除监管漏洞,全面指导属地监管部门有效落实监管责任,企业有效落实产品质量安全主体责任。
奇亿娱乐(中国)有限公司是全国最早开展医疗器械注册人制度咨询服务的机构之一,任何有关医疗器械注册人制度相关咨询,欢迎您随时方便与奇亿娱乐(中国)有限公司联络,联系人:邓先生,电话:18060130531,微信同。
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
奇亿娱乐(中国)有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。