24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
中国医疗器械出口,欧盟市场是大部分企业都会选择的。了解欧盟对医疗器械的分类很有必要。
欧盟跟据医疗器械的预期用途和它们的固有风险,将医疗器械分为I类、IIa类、IIb类和III类。

欧盟医疗器械的分类主要依据MDR附录VIII的分类规则进行的。本文章后面的内容将详细介绍欧盟分类规则的相关内容。
一. 特定于分类规则的定义
在看分类规则之前,首先需要了解一些关键的会影响设备分类的定义:
使用时间(Duration of use)
产品的使用时间不应被视为使用产品所需的时间,而是产品在体内或身体上停留的时间。
使用时间定义了以下三种:
短暂(Transient): 预期正常持续使用不超过60分钟。
短期(Short term): 预期正常持续使用60分钟至30天。
长期(Long term): 预期正常持续使用超过30天。
注意:持续使用(Continuous use)的定义:
(a)同一器械的整个使用期间,不考虑在使用过程中的暂时中断或出于器械清洁/消毒等目的的暂时移除。是否中断使用或者暂时移除器械,应当根据中断使用或者移除期间前后的使用时间确定;
(b)器械累积使用,即制造商预期器械使用过程中会由另一相同型号迅速替换。
侵入性器械(Invasive device)
全部或部分通过身体孔口或身体表面进入身体内部的器械。
如果一个向人体输送能量的器械只是发射的能量穿透人体而不是器械本身,则不应该被认为是侵入性的。
注意:身体孔口(Body orifice)的定义:身体的任何天然开口,以及眼球的外表面,或任何永久性人工开口,如造口。
外科侵入性器械(Surgically invasive device)
一种侵入性器械,借助于外科手术或在外科手术的情况下,通过身体表面(包括通过身体孔口的粘膜)进入体内,或不通过身体孔口穿透的器械。
植入式器械(Implantable device)
任何器械,包括部分或全部吸收的器械,用于:完全进入人体,或通过临床干预来替换上表皮或眼表面,并在手术后保留原位。
注意:任何拟通过临床干预部分引入人体并在手术后至少30 天内保持原位的器械也应视为植入式器械。
可重复使用外科器械(Reusable surgical instrument)
是指通过切割、钻、锯、刮、夹、收缩、剪切或类似方式用于外科使用的器械,不连接有源器械,制造商预期可通过适当的处理(如清洁、消毒和灭菌)后再次使用。
有源医疗器械(Active medical device)
是指任何器械,其操作依赖于除了由人体或重力产生的能量之外的能量来源,并且其通过改变该能量的密度或转换该能量而发挥作用。
用于在有源器械和患者之间传输能量、物质或其他元素而没有任何显著变化的器械不应被视为有源器械。
软件应被视为有源器械。
有源治疗器械(Active therapeutic device)
是指任何有源器械,无论是单独使用还是与其他器械组合使用,以支持、更改、替换或恢复生物功能或结构,以治疗或缓解疾病、损伤或残疾。
用于诊断和监测的有源器械(Active device intended for diagnosis and monitoring)
是指任何有源器械,无论是单独使用还是与其他器械组合使用,用于为检测、诊断、监测或治疗生理病症、健康状况、疾病或先天性畸形提供信息。
中央循环系统(Central circulatory system)
指以下血管:肺动脉、升主动脉、弓主动脉、动脉分岔的降主动脉、冠状动脉、颈总动脉、颈外动脉、颈内动脉、脑动脉、头臂干、心静脉、肺静脉、上腔静脉和下腔静脉。
中枢神经系统(Central nervous system)
是指脑、脑膜和脊髓。
二、应用分类规则时的注意点
在选择适用的分类规则时,需注意以下5点:
1.分类规则的使用应基于器械的预期用途。
2. 不同器械共同,分类规则应分别适用于各器械。医疗器械和附录XVI所列产品的附件,应根据其自身因素进行分类,独立于它们所适用的器械。
3. 软件,若驱动或影响器械使用的,应与该器械归为同一类别。若独立于器械,则应按照其本身进行分类。
4. 如果器械不是单独使用或主要作用于身体的某个部位,应基于其最关键的特定用途来考虑和分类。
5. 基于器械的预期用途,若多个规则(或同一规则的多个子规则)同时适用于同一器械,则应采用能带来更高分类等级的最严格规则和子规则。
三. 欧盟分类规则
欧盟分类规则总共22条,大概框架如下:
无创器械分类规则:Rule 1-Rule 4
侵入性器械分类规则:Rule 5-Rule 8
有源器械分类规则:Rule 9-Rule 13
特殊规则:Rule 14-Rule 22
具体的分类规则简介如下:
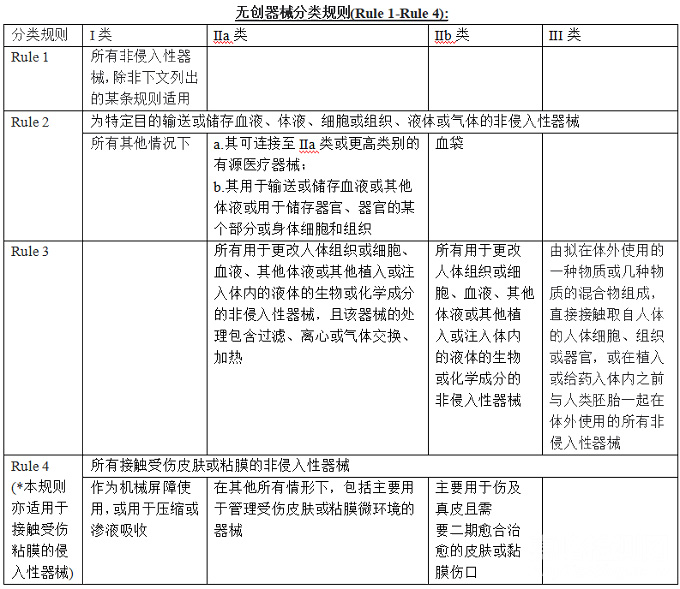
无创器械分类规则(Rule 1-Rule 4):
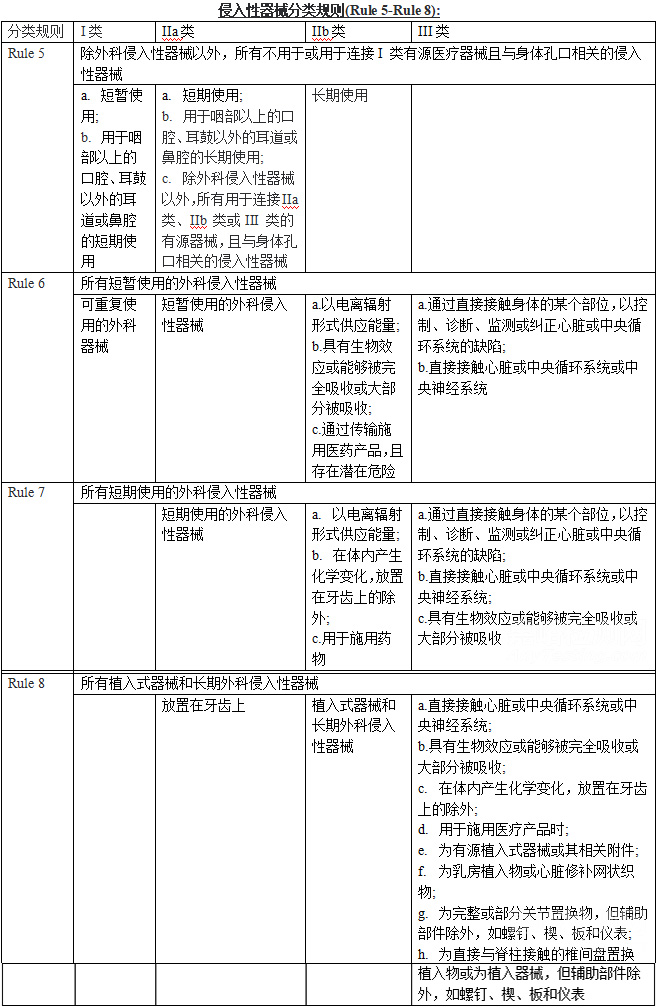
侵入性器械分类规则(Rule 5-Rule 8):
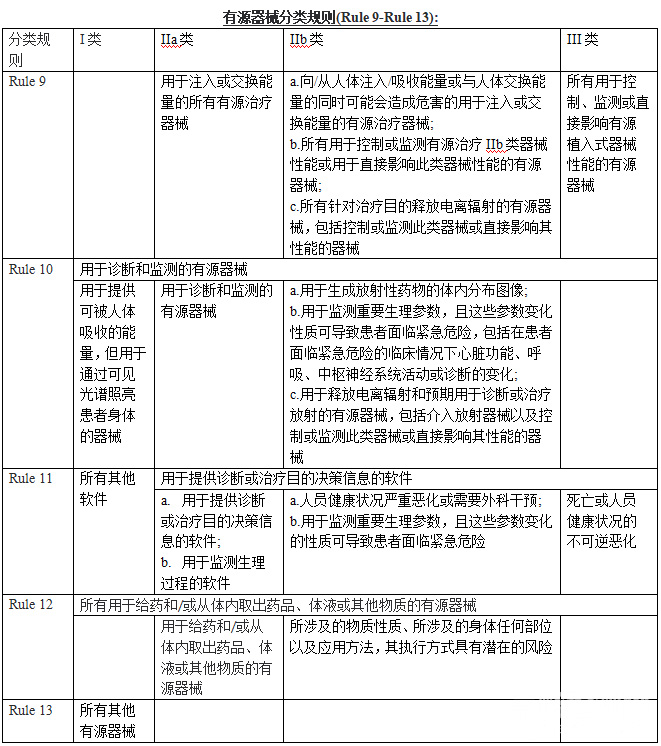
有源器械分类规则(Rule 9-Rule 13):
特殊分类规则(Rule 14-Rule 22):

站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
奇亿娱乐(中国)有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。