24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
虽然英国已经脱离欧盟,但是这场纷争远未结束。脱欧的过渡期即将在艰难的2020年之后结束。2020年9月1日,英国商业、能源和工业战略部在其官方网站上正式宣布:从2021年1月1日起将使用UKCA标志。同日,英国医药保健产品监管局(MHRA)也发新的指导原则,说明2020年1月1日起对医疗器械监管的新要求。今天和大家一起详细解读一下这份新的指导原则。

新发布的文件只是一份指导原则。我们知道一国政府部门是法律法规的执行部门,不可能仅仅依据一份指导原则来对一个行业的产品进行监管。那么在2021年1月1日之后英国市场对于医疗器械的法规是什么呢?
答案是目前英国医疗器械法规2002(UK MDR 2002)将持续生效。UK MDR 2002是基于欧盟三大医疗器械指令进行立法的,即:
90/385/EEC 有源植入医疗器械指令
93/42/EEC 医疗器械指令,和
98/79/EC 体外诊断医疗器械指令。
在这里我们不得不额外说一下指令和法规的区别。欧盟指令要求欧盟成员国达成确定的目标,但并不限制成员国达成目标的方法。即成员国要依据指令进行国内立法才可以将指令的要求转换为其国内具有强制性的法规要求。所以虽然指令是统一的,但是每个国家在一些程序上并不是一致的,最典型的例子是医疗器械在各国上市注册(Registration)的要求,这个就体现在每个国家的法规中。而新发布的欧盟医疗器械法规和体外诊断器械法规则不同,它们是直接的法规,由欧盟批准后即对所有的成员国直接生效而不需要再进行国内立法。
所以新的MDR和IVDR将不会适用于英国(北奇亿娱乐兰除外),此外从某种程度上,在近期英国国内的医疗器械法规将继续延续三大指令的框架。
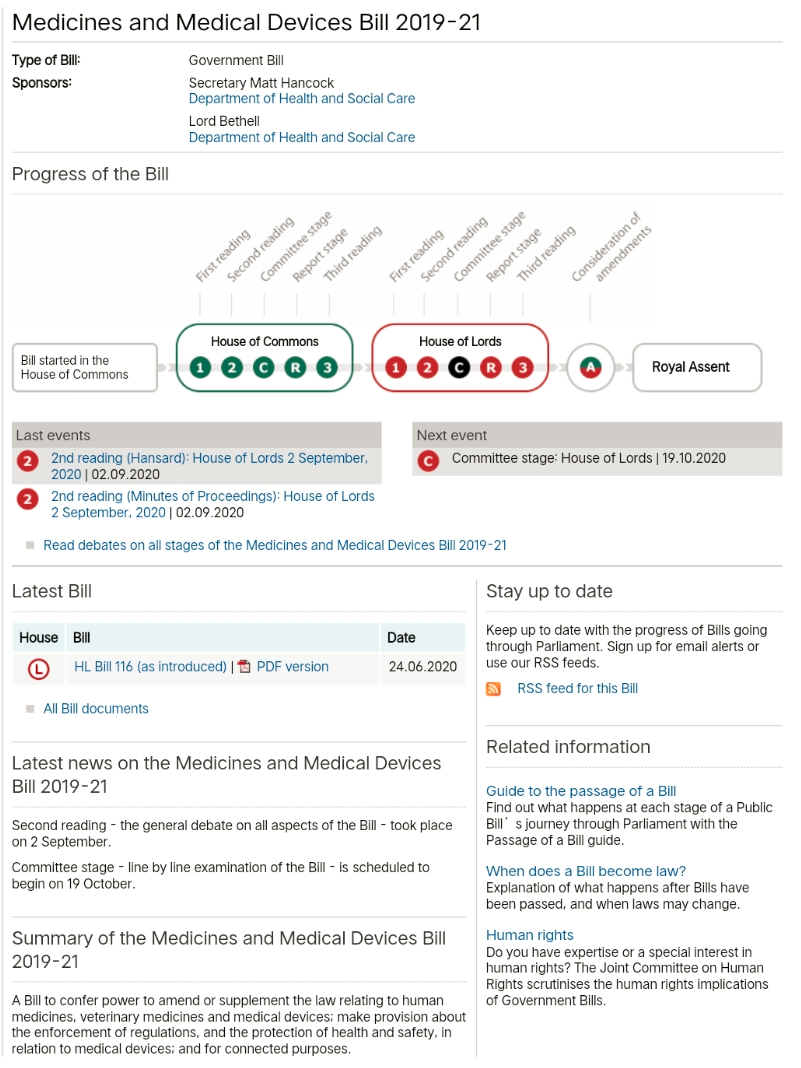
那么当我们去阅读UK MDR 2002的时候,我们会发现法规的通篇仍然都保留了CE认证的要求,所以为了使用新的UKCA认证,英国政府还需要对UK MDR 2002进行变更。我们也查到了英国议会最近在讨论的药品和医疗器械议案(Bill)2019-21,该议案授权了英国卫生部对UK MDR 2002进行必要的变更,并且根据指导原则的描述,脱欧向英国提供了建立一个强有力的,世界领先的医疗器械法规体制。是不是听上去像一个要超越EU MDR/IVDR的宣言。
2023.06.30之前欧盟CE标志和欧洲经济区(EEA)国家的公告机构颁发的CE标志证书将持续有效;
2021.01.01起,所有奇亿娱乐在英国境内销售医疗器械的厂商都需要向MHRA进行注册。该注册会根据风险等级划分不同的宽限期:
(1)4个月:III类和IIb类植入式,有源植入式医疗器械,IVD List A;
(2)8个月:其他IIb类,所有IIa类医疗器械器械,IVD List B, 自测IVD;
(3)12个月:I类医疗器械和通用IVDs。
上述宽限期不适用于现在按照法规要求需要向MHRA进行注册的I类和通用IVD产品。
类似于欧盟授权代表,向英国境内(不包含北奇亿娱乐兰)销售医疗器械的厂商,如果不在英国境内,则必须指定一个位于英国境内的英国责任人。指定的时间与MHRA注册的宽限期一致。
英国责任人的职责之一是进行非英国制造商的注册。此外,还有一些与欧盟授权授权代表一致的职责:
(1)确保有符合性声明(DOC)和技术文件;
(2)保留一份这些文件和相关证书的复印件;
(3)确保应用适当的符合性评估程序;和
(4)配合MHRA要求的文件,等.
估计要等待英国立法完成后才能开始进行UKCA认证。但是2023年6月30日之后所有的医疗器械都需要UKCA的标志,包括已经获得CE认证的医疗器械。
2021.01.01,医疗器械必须贴上欧盟CE标志或UKCA标志。2023.07.01,UKCA标志将强制适用于所有医疗器械。只要产品符合欧盟法例及英国新法例,在2023.07.01后,产品可同时贴上CE标志及UKCA标志。
MHRA将负指定UKCA认证的符合性评估机构(即类似于欧盟公告机构的角色),但是参考MDR的公告机构认可的进度,奇亿娱乐MHRA会有更高的效率,因为毕竟也只有3年的过渡期。
与位于不列颠岛的3个构成国不同,北奇亿娱乐兰被留在了“欧盟框架下”。在北奇亿娱乐兰上市的医疗器械将继续适用欧盟的MDR/IVDR,以及认可欧盟公告机构颁发的CE证书而非UKCA证书。如果一个医疗器械是被英国承认的机构评估的,需要增加UK(NI)标志,但它不会取代CE标志。
需要注意:同时带有CE标志和UK(NI)标志的产品不能进入欧盟市场。带有UKCA标志的医疗器械将不可进入北奇亿娱乐兰,除非带有CE标志或UK(NI)标志。
如果制造商的总部不在英国、北奇亿娱乐兰、欧盟或EEA,他们必须指定一个英国负责人,除非他们指定了一个总部在北奇亿娱乐兰的授权代表。一旦该授权代表自己和医疗器械在MHRA注册,这些医疗器械就可以进入英国市场。
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
奇亿娱乐(中国)有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。
下一篇:受试者相关费用报销SOP模板