24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
生物相容性是指生命体组织对非活性材料产生反应的一种性能,一般是指材料与宿主之间的相容性。生物材料植入人体后,对特定的生物组织环境产生影响和作用,生物组织对生物材料也会产生影响和作用,两者的循环作用一直持续,直到达到平衡或者植入物被去除。
生物相容性可以分为生物学反应和材料反应两部分,其中生物反应包括血液反应,免疫反应和组织反应;材料反应主要表现在材料物理和化学性质的改变。
生物相容性主要决定于材料的性质和用途。材料及制品本身的性质,包括形状、大小及表面粗糙程度,材料聚合或制备过程残留的有毒低分子物质、材料加工工艺污染、材料在体内的降解产物等都与其生物相容性相关。材料与机体短期接触会对细胞及全身产生毒性、刺激性、致畸性和局部炎症;长期接触可能具有致突变、致畸和致癌作用;与血液接触引起凝血功能异常和溶血等,因此,当考虑将材料用于生物医学领域时,其生物相容性是需要考虑和评价的重要指标。

1 有源产品相关
多参数监护仪、超声诊断设备、输液泵和输液控制器、体温计、无创血压检测设备、脉动光电血氧计设备、高频电外科手术设备、神经和肌肉刺激器、内窥镜、脑电图机、手术、化妆、诊断和治疗激光设备、心电诊断设备、临床化学分析仪器、免疫化学分析仪器、全自动血液分析仪器、微生物分析仪器,全自动蛋白分析仪,生化分析仪,血球分析仪,血气分析仪,化学发光免疫分析仪,尿沉渣分析仪,血凝仪,全自动血液流变仪,全自动内细菌培养分析仪,微生物鉴定及细菌药敏分析仪,核酸纯化仪,血液组织培养仪,冷冻切片机,生物组织脱水机,组织包埋机,离心机,搅拌机,染色机,高温脉动真空灭菌器,高温蒸气灭菌器,红外电热灭菌器,高温消毒清洗机,生物安全柜等。
2 无源产品相关
1)表面接触器械:
电极、体外假肢、固定带、压缩绷带、和各种类型的监测器等;
接触镜、导尿管、阴道内或消化道器械(胃管、结肠镜、胃镜)、气管内插管、支气管镜等;
用于溃疡、烧伤、肉芽组织的敷料或护理器械和封闭敷贴等。
2)外部接入器械
输血、输液器、延长器、转移器等
腹腔镜、关节内窥镜、引流系统、牙科充填材料、皮肤钉等
血管内导管、临时性起搏电极、透析器、透析管路和附件、血管吸附剂、免疫吸附剂等
3)植入器械
矫形钉、人工关节、骨假体、骨水泥和骨内器械,起搏器、植入性给药器械、神经肌肉传感器和刺激器、人工肌腱、乳房植入物、人工喉、骨膜下植入物、结扎夹等
起搏器电极、人工动静脉瘘管、心脏瓣膜、人工血管、体内给药导管和心室辅助器械等
现阶段生物相容性检测所参考的标准是ISO10993和GB/T16886,两种标准的内容基本相同,ISO10993和GB/T16886标准对具体的生物学评判过程开展了明文规定,在开展生物相容性实验之前须要鉴别材料成份,并做化学表征检测。体外诊断产品并不和身体直接接触,ISO10993和GB/T16886标准不适用于此类产品,其它与身体直接接触的有源医疗器材和无源医疗器材的安全评价都需按照程序开展检测。
| 体外细胞毒性试验 | 鼠伤寒沙门氏菌回复突变实验 | 致敏试验 |
| 基因突变试验 | 皮肤刺激试验 | 血栓形成试验 |
| 皮内刺激试验 | 凝血试验 | 急性全身毒性试验 |
| 亚急性全身毒性试验 | 血小板粘附试验 | 补体激活试验 |
| 亚慢性全身毒性试验 | 慢性全身毒性试验 | 肌肉植入试验 |
| 溶血试验 | 热源试验 | 染色体畸变试验 |
| 骨植入试验 | 材料特征分析 | 皮下植入试验 |
1 细胞毒性测试
• 细胞毒性测试(MTT法)(ISO 10993-5)
• 细胞毒性测试(琼脂法)(ISO 10993-5 / USP 87)
• 细胞毒性测试(滤膜法)(ISO 10993-5)
• 细胞毒性测试(直接接触法)(ISO 10993-5 / USP 87)
• 细胞毒性测试(洗脱法)(USP 87)
2 皮肤刺激和致敏测试
• 致敏测试(最大剂量法 / 斑贴法)(ISO 10993-10)
• 皮肤刺激测试 (ISO 10993-10)
• 皮内刺激测试 (ISO 10993-10 / USP 88)
• 口腔刺激测试(需组织病理读片)(ISO 10993-10)
• 阴道刺激测试(需组织病理读片)(ISO 10993-10)
• 阴茎刺激测试(需组织病理读片)(ISO 10993-10)
• 直肠刺激测试(需组织病理读片)(ISO 10993-10)
• 眼刺激测试 (ISO 10993-10)
3 全身毒性测试
• 急性全身毒性测试 (ISO 10993-11 / USP 88)
• 亚急性全身毒性测试(ISO 10993-11)
• 亚 / 慢性全身毒性测试(ISO 10993-11)
• 热原测试 (ISO 10993-11)
4 植入后局部反应测试
• 皮下植入测试 (ISO 10993-6)
• 肌肉植入测试 (ISO 10993-6)
• 骨植入测试 (ISO 10993-6)
5 血液相容性测试
• 溶血测试 (ISO 10993-4 / GB16886.4)
• 溶血测试 (ASTM F756)
• 凝血测试 (ISO 10993-4 / GB16886.4)
• 血小板计数测试
• 补体测试 (ISO 10993-4 / GB16886.4)
• 血栓测试(体内、体外)(ISO 10993-4 / GB16886.4)
6 基因毒性 / 遗传毒性测试(ISO 10993-3)
• 细菌回复性测试
• 小鼠淋巴瘤测试
• 染色体畸变测试
• 微核测试(小鼠)
上面简单了解了生物相容性名词解释和生物相容性检测相关基础知识,样品是确保检测结果有效性的一个非常重要的环节。那么对于我们常见的生物相容性的测试而言,如何准备样品呢?这里面其实有很多细节的要求。国际标准组织(ISO)还特别为样品的准备建立了一份标准(ISO 10993-12)。将分上、下两篇来和大家讨论如何准备生物相容性检测的样品。
在按照ISO 10993标准进行生物学评价试验时,需要满足ISO 10993-12规定的医疗器械所要遵循的样品制备的要求,以保证评价结果的有效性。
在了解样品制备之前,我们需要对过程中会出现的重要名词进行了解学习,我们将一些术语进行了整合分组,方便大家进行对比理解。
试验样品(Test Article):用于生物学或化学试验评价的医疗器械、组件或材料,或用相同方法生产和加工的具有代表性的样品,也可以是其浸提液。
合法上市的对照品(Legally Marketed Comparator Device):合法上市的对照样品,与试验样品具有相似的设计、材料和临床用途,是经过批准、许可的,被认为是安全的医疗器械。
对于没有明确接受准则的生物学评价项目(血栓,PTT,补体激活等),需要引入合法上市的对照品,来辅助评价检测样品的检测结果。
合法上市的对照品应该已经在试验样品预期目标市场上市,如果有多个目标市场,那么合法上市的对照品需要同时满足多个市场的上市要求。例如,如果检测报告预期用于中国注册,则合法上市的对照品应当有中国的医疗器械注册证,如果检测报告预期用于欧盟认证,则合法上市的对照品应当有CE标志。
可沥滤物(Leachables):某一试验样品在临床使用过程中能释放出的物质。
可浸提物(Extractables):将某一试验样品置于浸提溶剂中,模拟临床使用的条件,或者用更严格的条件进行浸提,所能释放出来的物质。
由于实验室很难模拟医疗器械的临床使用过程,实验室一般使用可浸提物来代替可沥滤物作为生物学评价的研究对象。
空白对照(Blank control):在浸提期间,置于与试验材料同样的容器中,并采用同样的浸提条件,不含试验材料的浸提介质。
阴性对照 (Negative control):经充分表征的材料/或物质。当按规定步骤实验时,这种材料在实验系统中证明实验步骤的适宜性,能出现重现性的、适当的阴性、无反应或最小应答。
阳性对照 (Positive control):经充分表征的材料/或物质。当按规定实验方法评价时,这种材料证明实验系统的适宜性,能在实验系统中出现重现性的、适当的阳性或反应性应答。
空白对照,阴性对照和阳性对照是实验室常用的试验对照。试验对照的设立是为了评价试验系统的反应是否具有重现性和适宜性。例如,空白的目的是为了评价浸提容器、浸提介质和浸提过程可能产生的干扰作用;阴性对照是为了证明试验系统可以产生阴性反应,以防结果产生假阳性;阳性对照是为了证明试验系统可以产生阳性反应,以防结果产生假阴性。我们可以根据具体的试验系统来选择合适的对照组。另外,体内实验中阳性对照的选用需要考虑动物保护法规的影响,不需要也应避免造成最高等级的反应。
除了上面的几对重要术语,我们还需要了解稳定性的概念:
稳定性(Stability):当存储在规定的条件下,材料符合其定性的要求的能力,在特定的时间周期内,特定的限度内,维持特定的宣称的生物反应。
在准备样品时,应注意保证最长测试周期的生物学评价项目在测试期间试验样品是要在有效期范围内的。如果要评价有效期后产品的生物相容性,则可以使用“过期”的产品进行试验。
在生物学评价的测试中,对重要的术语的了解仅仅是第一步。委托人更关心如何选择试验样品。那么选择试验样品的原则是什么呢?
选择试验样品时,最重要的原则是样品能够代表最终“临床使用状态”。在这个原则下,试验样品可以是最终产品、取自最终产品中有代表性的样品或与最终产品以相同的工艺过程制得的材料或者以上样品或材料制备的适合的浸提液。来自制造过程的任何残留物(如酸洗剂,粘合剂)应视为样品部件或组件的构成部分,检测前不得移除,除非临床使用前有相关的移除步骤。
此外,现在有很多复杂的器械,一部分与人体接触,一部分不与人体接触。对于不与人体接触的部分,我们要考量一下,究竟是绝对不与人体接触,还是有可能与人体接触。只要属于有可能的情况,则都要被包含在生物学评价的范畴内。对于不与人体接触的部分,应尽可能排除在检测外。
很多情况委托人需要我们对样品进行前处理。前处理包括蒸汽灭菌,低温等离子灭菌,清洗或消毒等方式。哪些情况下我们建议进行前处理呢?
产品在临床使用时需要进行前处理。这种情况我们要遵从临床使用状态对产品进行相应的前处理。
测试项目的特殊要求,例如细胞毒性试验要求使用无菌样品。对于临床使用状态为非无菌状态的产品,原则上测试时应该使用非无菌产品,但是非无菌产品本身含有的微生物会对细胞毒性检测的测试系统造成损害,直接影响检测结果,所以会对样品进行一些的前处理。我们推荐的前处理方式为酒精喷洒等低等级消毒。在能够保证灭菌处理不会对试样样品造成影响的前提下也是可以选用其他灭菌处理,可选用的灭菌处理方式有蒸汽灭菌,低温等离子灭菌和化学灭菌。
除以上情况,我们均不建议对样品进行前处理,如需进行前处理,委托人需要有充分的理由来证明对样品进行前处理不会影响检测结果。
我们知道很多生物相容性检测的项目都会使用浸提样品的方式来获得浸提液,最终与测试系统接触的是样品的浸提液而非样品本身。所以浸提过程也是至关重要的一个环节。
浸提这个环节主要需要确定的是:委托人对于浸提温度、浸提时间、浸提比例和浸提介质的选择,实验室浸提前样品的制备原则,以及浸提过程中需要注意的问题。
关于温度和时间的选择,依照标准中的建议,有以下几组推荐的组合:
a)(37±1)℃,(24±2)小时;
b)(37±1)℃,(72±2)小时;
c)(50±2)℃,(72±2)小时;
d)(70±2)℃,(24±2)小时;
e)(121±1)℃,(1±0.1)小时。
以上的温度和时间也可以自行组合,在做选择时需要坚持以下三个原则:
1.选择产品可以耐受的最高温度;
2.可以体现临床使用中的最坏情况;
3.依据具体测试需求。
生物相容性测试中,细胞类实验的浸提介质大都会选用含血清培养基,那么为保证血清等成分的稳定性,只能选择37℃的浸提温度。因此,细胞毒性测试可采用组织培养液( 37±1 )℃浸提(24±2)h。但浸提时间也是可以根据不同的情况进行调整的,比如:
a)对于短期接触完整皮肤和粘膜的非植入类器械,浸提时间可少于24小时,但不少于4小时;
b)对于长期或持久接触的医疗器械,细胞毒性测试建议采用72小时浸提时间。(2021版ISO10993-12新增)
根据ISO 10993-12标准的建议,浸提过程应优先选择表面积比例浸提的方式,除非表面积不可计算,才可以使用重量比浸提的方式。
2021版ISO10993-12推荐使用的浸提比例:
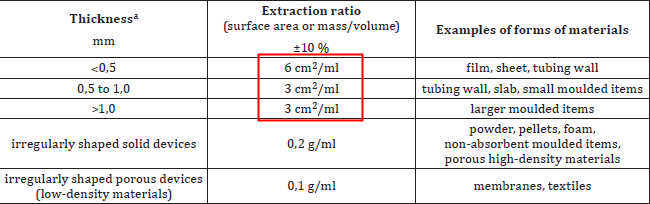
对于上表的内容,我们还有以下补充:
◈浸提比例如果不在常规范围内,使用前需要进行论证。(如:器械有不同厚度的多个部位;样品为橡胶和乳胶等材料)
◈其他模拟临床的浸提条件也可以使用(例如,输液管路产品可以使用填充法),需记录浸提液体积和对应表面积,并需说明理由。(FDA Guidance )
◈现在尚无测试吸收剂和水胶体的标准化方法,可以通过测定吸附量(每0.1g或1.0cm2材料所吸收的量),并额外加入吸附量来进行测试。
在实验时,我们应同时使用极性和非极性浸提介质对检测样品进行浸提。如果只使用一种介质,则须提供理据。
除了这些方面,在进行浸提的时候,我们还应注意一些问题,规范我们的浸提操作,以保证实验的真实性。
a)浸提应在搅拌或循环条件下进行。如需静态浸提,应加以论证、规定并保留记录;
b)浸提液应在制备后立即使用,以防止浸提液发生变化。浸提液如存放时间过长,则需确认贮存条件下浸提液的稳定性和均匀性;
c)浸提完成后应观察浸提液的性状,包括颜色,澄清/浑浊,是否存在颗粒;
d)一般不调整浸提液的pH值,也不应去除悬浮的粒子(如离心、过滤等),如必要进行时,应验证其合理性。
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
奇亿娱乐(中国)有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。