24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
以医疗器械为主的药械组合产品如何申报注册?随着科学技术的发展,越来越多的创新型组合产品不断涌现,药械组合产品也更多的出现在医疗器械和药品的目录中,今天笔者就简要的聊一聊以医疗器械作用为主的药械组合产品(以下简称“含药医疗器械”)的注册申报。

首先,什么是药械组合产品呢?药械组合产品系指由药品与医疗器械共同组成,并作为一个单一实体生产的产品。而以药品作用为主的药械组合产品,需申报药品注册;以医疗器械作用为主的药械组合产品,需申报医疗器械注册。
从定义就可以发现,药械组合产品有其区别于单纯的医疗器械和药品的特殊之处,对此NMPA也有相应的法规文件对这类特殊产品做出指导,要开展这类产品的注册申报,首先应熟知这些指导文件,笔者简要列举如下:
1、《关于药械组合产品注册有关事宜的通告》(2009年第16号)
2、《关于调整药械组合产品属性界定有关事项的通告》(2019年第28号)
3、《含药医疗器械产品注册申报资料撰写指导原则》
4、《药械组合产品技术审评简介》(原创 2018-04-19 CMDE 中国器审)
另外,技术审评中心针对部分药械组合产品已形成了相应的注册审查指导原则,如含银敷料、全降解冠状动脉药物洗脱支架、冠状动脉药物洗脱支架等,相关产品可参考其指导原则。

那么,对于一款可能为药械组合产品的注册申报,我们应该怎么做呢?
一、申请属性界定
对于是否为药械组合产品,及是以器械为主还是以药品为主的判断,因产品的特殊性和多样性,可能难有全面明确的指导文件进行区分。《医疗器械分类目录》对部分产品已有界定,如含药中心静脉导管、带药球囊扩张导管、含药丙烯酸树脂骨水泥、药物洗脱冠状动脉支架、含蛋白质-2(rhBMP-2)的骨修复材料、含药导尿管、含碘手术薄膜、含铜含吲哚美欣宫内节育器等。但仍有很多产品需要针对性的分析和判断,从实际的角度,申请人应对自己的产品有相应的判断和主张,作为对产品最了解的一方,通过对产品结构组成、作用机理等的深入研究,形成强有力的理念并传达至药监部门,而分类界定申请和属性界定申请可以帮助申请人确认其判断。
申请人通过中国食品药品检定研究院(国家药品监督管理局医疗器械标准管理中心)网站(网址:)进入“医疗器械标准与分类管理”二级网站(网址:),点击进入“”,填写《药械组合产品属性界定申请表》,并上传其他申请资料,提交属性界定申请。
申请人登陆“药械组合产品属性界定信息系统”即可查询申请状态和结果。具体看这:药械组合产品属性界定工作流程
二、产品注册
1、管理类别
若产品被界定为含药医疗器械,则申报三类医疗器械注册。(根据《医疗器械分类规则》,以医疗器械作用为主的药械组合产品,按照第三类医疗器械管理。)
2、设计开发
含药医疗器械的设计开发,不应单单局限于医疗器械的设计开发思路,更需要关注药械组合产品的立题依据、作用机制、药物与器械的相互作用、组合后产品的奇亿娱乐险和新问题、终产品的整体评价等,并同时参考药品和医疗器械的相关要求,充分考虑组合产品中药品部分的审评要求。
含药医疗器械的申请人多为医疗器械制造企业,由于习惯了医疗器械的设计开发思路,在界定成以器械为主的组合产品后,容易在药品部分的研究上“知难而退”或者选择性的忽视,在研发、组织生产、检测、临床试验和准备注册申报资料等过程中,存在未充分考虑组合产品中药品部分的审评要求等情况,最终在体系核查、最后的技术审评环节被质疑。
3、注册申报
产品的各项研究完成后,申请人以第三类医疗器械的注册申报途径,向国家局申报产品注册,同时申请表中注明“药械组合产品”。含药医疗器械由医疗器械技术审评中心牵头审评,最终审批取得医疗器械注册证书。
4、药械联审
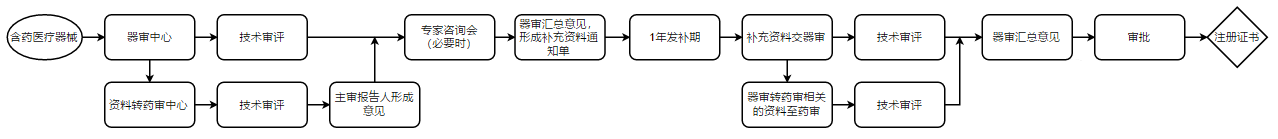
由于药械组合产品具有创新性和复杂性,特别是创新型组合产品,单一审评中心通常难以单独完成药械组合产品的全部安全性、有效性评价,基于此,国家局也创新性的引入了药械联审机制。根据药械组合产品联合审评工作程序,对于技术较为成熟、已有同类产品在我国上市,且无重大不良反应或不良事件的,经牵头单位评估,可由单一审评中心独立承担技术审评工作;经评估需要联合审评的,牵头单位可将注册申报资料同步转协作单位进行联审;必要时,牵头单位可组织两家审评中心的相关负责人和主要技术审评人员召开工作协调会议,或联合召开专家咨询会议;需要联合审评的,两家审评中心分别针对相应审评部分出具补充资料意见或审评意见,由牵头单位汇总,全面评价产品的整体安全有效性,出具最终审评结论。
药械组合产品需与药品审评机构联合审评的,所需时间不计算在审评时限内,技术审评机构应当将所需时间书面告知申请人。
在此过程中,作为申请人,企业必须对药械联审有充分的预估。药审和器审虽然在产品审评的底层逻辑上是一致的,但毕竟仍有区别。企业需要应对两个部门的思路,这极有可能在难度和时间上出现1+1>2的情况。
(拖出查看大图)
5、沟通咨询途径
器审方面:现场咨询、网上咨询、共性问题解答、补正资料预审查
登录器审中心网站(),进入技术审评咨询平台。
根据《咨询平台使用说明》的指导进行操作,预约"现场咨询"或"网上咨询"。
进入应急、创新程序的产品,其注册技术审评咨询工作按相关规定进行!
相关指导文件:
《医疗器械技术审评咨询管理规范》
《关于进一步规范预约咨询工作流程的通知》
《总局关于发布医疗器械审评沟通交流管理办法(试行)的通告》
《关于提供医疗器械技术审评补正资料预审查服务的通告》(2018年第8号)
《器审中心关于对外咨询工作的通告》(2019年第2号)
药审方面:问询式沟通交流、向CDE提出沟通交流会议申请、向CDE提出一般性技术问题咨询、CDE提出的沟通交流会议等。
登录药审中心网站(//www.cde.org.cn/),进入申请人之窗,于沟通交流栏目,选择适当的沟通交流方式。CDE网站《申请人之窗》频道采用实名身份验证和CA单位数字证书认证安全机制,申请人按要求申请和办理。

相关指导文件:
《药品审评中心与注册申请人沟通交流质量管理规范(试行)》
《药品注册审评一般性技术问题咨询管理规范》
《药物研发与技术审评沟通交流管理办法(试行)》
6、进度查询
器审方面:登录器审中心网站(//www.cmde.org.cn/),进入申请人之窗,或办事大厅的审评进度查询。

药审方面:登录药审中心网站(//www.cde.org.cn/),进入申请人之窗,通过申报品种一览、进度查询等栏目查看。申请人之窗的部分功能需要Ukey进入才可查看,建议申请Ukey,申请途径参考申请人之窗相关说明。

结语
内容所限,本次主要讨论了含药医疗器械注册申报中技术审评相关的内容,在整个注册申报过程中,还有两项重要环节,即注册质量体系核查和临床试验现场检查,奇亿娱乐后续有机会继续分享。
来源:小正医学-XZYX
药械组合产品奇亿娱乐相关的文章推荐:
【精品】一文搞懂药械组合产品分类界定和申报流程
药械组合产品注册技术审评关注点
药械组合的定义|目前已上市的药械组合产品有哪些?
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
奇亿娱乐(中国)有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。