24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
在医疗器械的广阔领域中,口咽/鼻咽通气道独具一席之地。按照医疗器械分类标准,口咽/鼻咽通气道被编码为08-06-06,属于Ⅱ类管理。这一小小的设备,在保障患者上呼吸道通畅方面具有重要作用。让我们深入了解口咽/鼻咽通气道的构造、功能以及安全管理。

口咽/鼻咽通气道的结构与工作原理
这种器械为维护上呼吸道通畅而生。对于麻醉病人或昏迷病人,上呼吸道通路可能会被阻塞,造成呼吸不畅。这时,口咽/鼻咽通气道登场。通过将其插入口腔或鼻腔,前端支撑咽后壁,快速解除或减轻上呼吸道的梗阻,确保患者呼吸通畅。
这些通气道常由高分子材料制成,如聚氯乙烯(PVC)、丙烯腈-丁二烯-苯乙烯共聚物(ABS)以及硅橡胶。其设计简单,外观如图1和图2所示。图3和图4分别为口咽和鼻咽通气道的结构示意图。
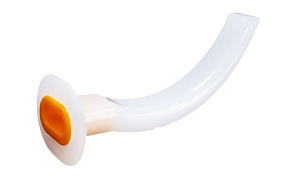
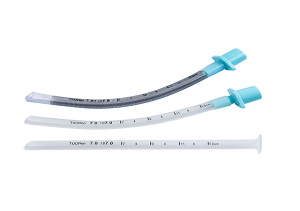
图1 口咽通气道 图2 鼻咽通气道
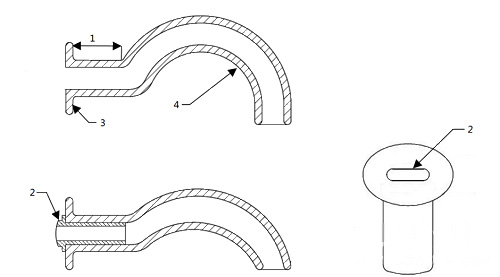
1-口颊部分;2-加强插入物,若提供;3-法兰盘端;4-通气道
图3 口咽通气道结构示意图
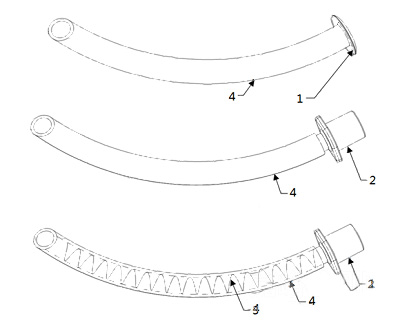
1-翼缘;2-接头;3-加强筋,若提供;4-通气道
图4 鼻咽通气道结构示意图
主要风险的管理与分析
对于这种医疗器械,风险管理至关重要。从设计、原材料、制造、包装到使用,每一个环节都可能涉及不同的风险。GB/T 42062标准提供了风险管理对医疗器械应用的指导,旨在全面识别风险,确保产品的安全性。
在风险管理过程中,生物学危险、环境危险、插入过程的危险以及功能失效带来的危险等都需要充分考虑。GB/T 42062和《医疗器械安全和性能的基本原则》的指引,为风险管理提供了方法和策略。
性能研究实验的要求
产品的性能研究是确保其合格的关键。参照相关标准,性能指标应包括外观、尺寸、规格标识、抗扁瘪、内腔畅通性、无菌、环氧乙烷残留量等。同样,生物学特性、灭菌工艺以及货架有效期等也是关键研究方向。
生物学相容性评价根据医疗器械生物学评价的要求进行,以确保产品与人体接触的安全性。而灭菌工艺研究则参考多个标准,包括环氧乙烷灭菌残留量等。
产品的货架有效期和包装
货架有效期是产品的关键特性之一。它涉及产品自身以及包装的有效期。验证项目、方法以及判定标准都需要明确。此外,包装完整性对产品的保护至关重要,需要进行相关验证研究。
在产品包装的设计和验证中,需要考虑多个因素,如物理化学性能、灭菌适应性、耐腐蚀性等。运输稳定性验证也是必要的,以证明产品在运输过程中不受不利影响。
免于临床评价医疗器械目录中的位置
在医疗器械领域的不断发展中,口咽/鼻咽通气道已被列入免于临床评价医疗器械目录。然而,对于开发人员来说,与目录中其他医疗器械进行比对,以及充分了解产品相关信息,仍然至关重要。
口咽/鼻咽通气道在医疗保障中扮演着不可忽视的角色。通过了解其构造、功能、风险管理以及性能研究实验的要求,我们能更好地认识和评估这一医疗器械,为患者的健康提供更可靠的保障。
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
奇亿娱乐(中国)有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。