24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
医疗器械出口加拿大,上市前需要做哪些准备工作?本文为大家讲解加拿大医疗器械市场准入知识点,文中含准入要求、注册流程、注册费用、MDSAP体系考核标准和产品分类查询汇总,奇亿娱乐能对你有所帮助。

1、加拿大医疗器械上市要求
加拿大卫生部(Health Canada)为医疗器械设立两种证书:
①medical device licences (MDL)
②medical device establishment licences (MDEL)
一旦获得证书,产品便能够在加拿大经销。
Once a device receives the appropriate medical device licence, it can be distributed in Canada.

MDEL证书
MDEL适用于进口,经销I到IV类医疗器械的用户以及生产I类产品的制造商。
MDELs are issued to companies that import (Class I to IV), distribute (Class I to IV) or manufacture (Class I) medical devices.
7步申请MDEL证书
Step1:阅读官方指南;
Step2:确定产品是否为医疗器械;
Step3:确定产品是否符合MDEL路径;
Step4:申请小企业费用减免(国内国际都适用):小企业定义:①少于100名员工;②年总收入在3万到5奇亿娱乐加币之间(between $30,000 and $5 million CAD)。
Step5:填写申请表格;
Step6:缴费/4590CAD;
Step7:提交申请(提交方式可选择发送邮件或者邮寄)。
*技术审评周期约为120天。

MDL证书
MDL适用于II,III,IV类医疗器械。
MDLs are issued for Class II, III and IV medical devices.
像III,IV类这些高风险的医疗器械,申请者必须提供临床有效性证明,这些证明包括临床试验,临床综述,变化分析和真实世界证明综述。
As Class III and IV medical devices pose the highest level of risk, applications for licensing must contain evidence of their clinical effectiveness. Such evidence includes clinical trials, clinical reviews, meta-analyses and real-world evidence reviews.
那么申请MDL证书需要哪些资料呢?
第一部分
(a)器械名称;
(b)器械分类;
(c)器械的标识符,包括属于系统、测试盒、医疗器械群组、医疗器械家族或医疗器械家族群的任何医疗器械的标识符;
(d)制造商的姓名与地址;
(e)若申请人的姓名与地址不同于制造商,请提供.
第二部分 II类器械还需要提供:
(a)有关制造、销售或代表该器械的医用条件、目的及用途的说明;
(b)标准清单;
(c)制造商的高级官员出局证明书证明制造商有客观证据证明该器械符合第10至20条的适用要求;
(d)产品标签的副本;
(e)在近病患的体外诊断器械(near patient in vitro diagnostic device)中,制造商的一名高级官员证明对该器械进行了调查测试;
(f)质量体系证书的副本.
第三部分 III类器械还需要提供:
(a)产品描述及其生产包装的原材料;
(b)产品特征描述,以证明它能应用于医学条件下,符合医用目的;
(c)除了加拿大以外,这一产品在哪些国家销售过,总数是多少,以及产品的问题和召回记录,列一个清单;
(d)标准清单;
(e)灭菌方法描述;
(f)研究总结;
(g)标签副本;
(h)IVD测试总结;
(i)关于器械的使用,安全和有效性的所有参考书目;
(j)质量管理体系证书的副本,证明器械的设计和制造的质量管理体系符合加拿大CAN/CSA-ISO 13485:2016《医疗设备-质量管理体系-监管要求》的国家标准。
第四部分 IV类器械还需要提供:
(a)产品描述及制造包装原材料;
(b)产品特征描述,以证明它能应用于医学条件下,符合医用目的;
(c)除了加拿大以外,这一产品在哪些国家销售过,总数是多少,以及产品的问题和召回记录,列一个清单;
(d)风险评估,包括对风险的分析和评估,以及为满足适用要求而采取的降低风险措施;
(e)质量计划,规定与器械有关的具体质量措施、资源和活动顺序;
(f)器械制造、包装所用材料的规格;
(g)制造流程;
(h)标准清单;
(i)制造商为确保器械符合第10至20条的适用要求所依赖的所有研究的详细信息包括:临床前及临床研究;工艺确认研究;软件验证研究;文献研究。
(j)动物或人类组织或其衍生物制造或合并的体外诊断器械以外的医疗器械,有客观证据证明该器械的生物安全性;
(k)IVD测试总结;
(l)(i)段所提述的研究的摘要,以及制造商从这些研究中得出的结论;
(m)第(k)段所述的调查测试的摘要和制造商从该测试中得出的结论;
(n)参考文献;
(o)标签副本;
(p)质量管理体系证书的副本,证明器械的设计和制造的质量管理体系符合加拿大CAN/CSA-ISO 13485:2016《医疗设备-质量管理体系-监管要求》的国家标准。

关于注册费(加币)
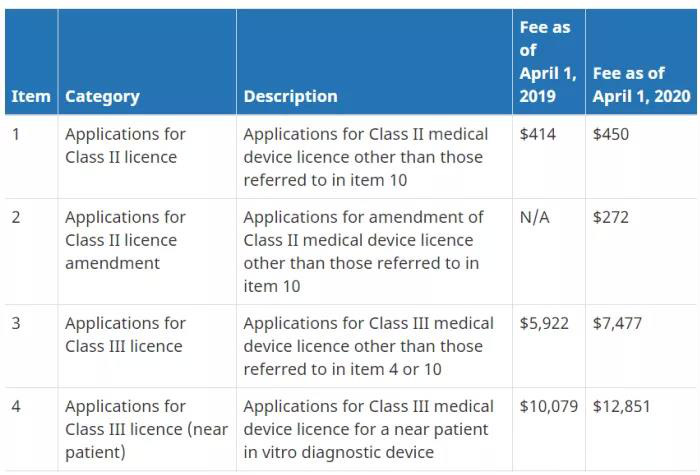
小结:一张图教你如何判断你需要办理哪种证书。


2、MDSAP体系考核
加拿大卫生部对持有MDEL的公司进行例行和积极的考核,考核包括以下3种可获得许可证的活动:
1. 制造I类医疗器械
2. 进口I至IV类医疗器械
3. 经销I至IV类医疗器械
过去对于II类至IV类的医疗器械,加拿大只认可Canadian Medical Devices Conformity Assessment System (CMDCAS) 下的registrars所颁发的quality system certificate。但自2019年1月1日起,CMDCAS已被MDSAP完全取代。
由加拿大卫生部和其他监管机构授权的其他考核机构,通过单独的程序对第II至IV类医疗器械的制造商进行考核,也就是Medical Device Single Audit Program (MDSAP),体系应符合ISO 13485:2016.
对外国公司的考核可以亲自进行,也可以从加拿大远程进行。当远程工作时,可以使用录像,视频会议和电话采访来检查设施和采访工作人员。

3、产品分类及查询方法
负责在医疗器械在加拿大上市销售之前对其进行审查,以评估其安全性、有效性和质量。加拿大卫生部将医疗器械分为I类至IV类,其中I类为最低风险,IV类为最高风险。
分类规则分为四部分,分别是非侵入性医疗器械,侵入性医疗器械,有源医疗器械和其他特殊规则,共16条。
如何查询分类?
数据库网址://health-products.canada.ca/mdall-limh/index-eng.jsp
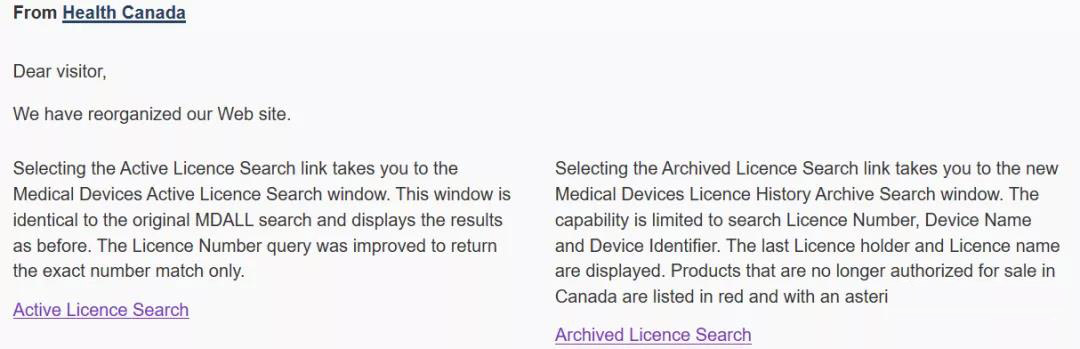
加拿大设了两个数据库,他们分别是Active Licence Search和Archived Licence Search。其中Active Licence Search可以通过器械名称,公司名称,公司ID,证书号码等关键词搜索出来,而Archived Licence Search相对比较局限。
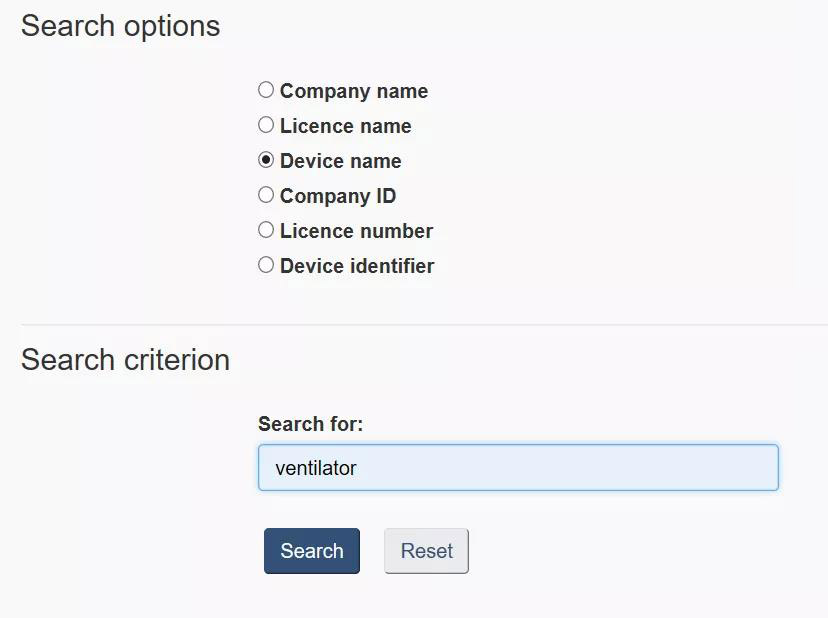
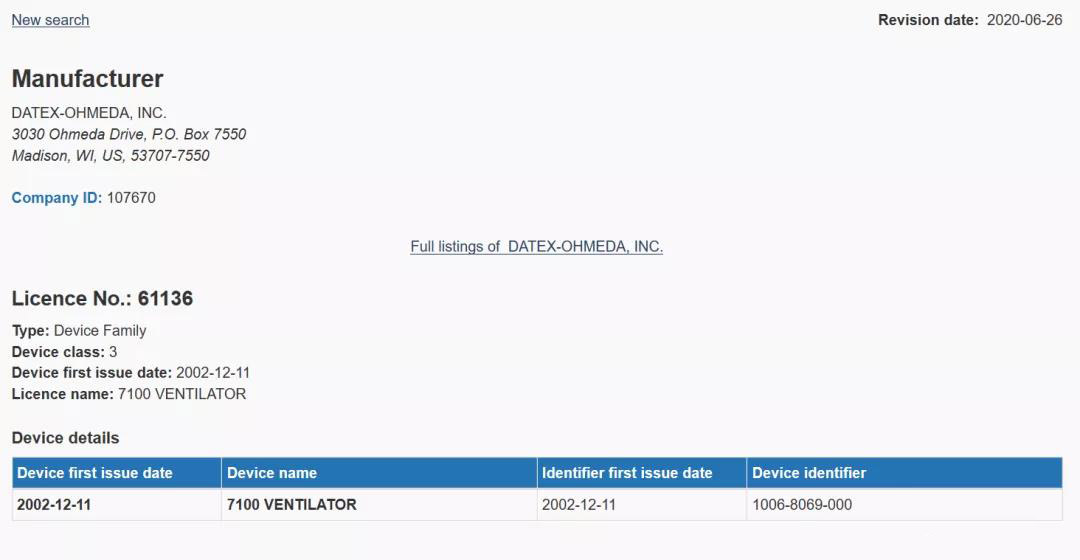
以Active Licence Search为例,我们点进去会出现Search options,选择Device name,也就是器械名称,相对地下面的Search criterion输入器械名称,如ventilator,也就是呼吸机,然后点Search。
进来后会显示Search Results,呼吸机一共有315个搜索结果,我们可以点进去看。
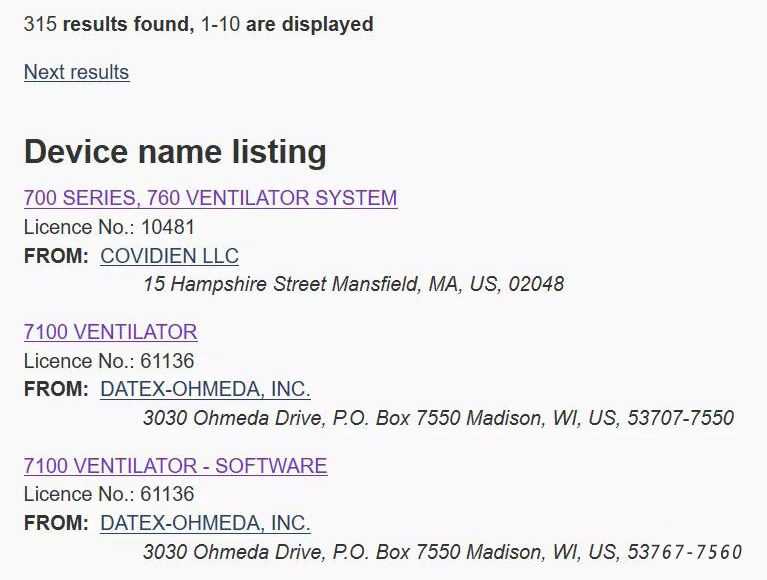
进来后,我们可以看到产品名称,产品类别,公司名称及其ID等。若该产品已不再具有上市资格,在Device details那一栏会显示红色。

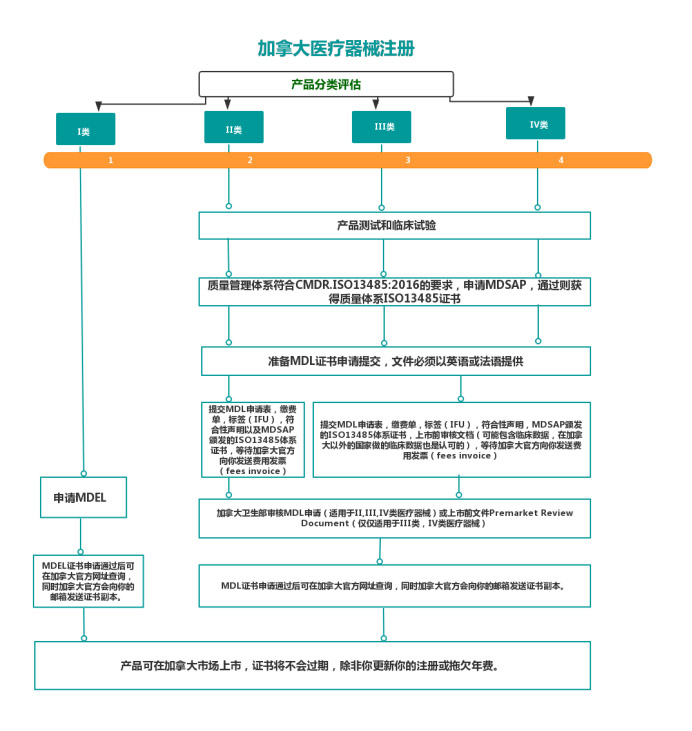
4、加拿大医疗器械注册流程图
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
奇亿娱乐(中国)有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。