24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us
关于药物临床试验机构备案的事火了快2个月了吧!临床试验,医院捞的油水可真不少......也许是看准了能盈利,各大三甲医院争先恐后的申请成为临床试验机构。近期如何给医院做药物临床机构做备案的咨询也较多,目前正在跟进的有鹤壁人民医院同时开展药物和医疗器械临床机构备案业务,销售人员也正在努力。到今天,药物临床机构备案制实施的第158天,截止到2020年5月7日下午3点共有335家医院完成药物临床机构备案。

众所周知,2019年11月29日国家药监局、国家卫生健康委发布了关于药物临床试验机构管理规定的公告,同时意味着药物临床试验机构由认证制转变为备案制,在已备案的335家机构中,列明了机构属性、级别、地区、专业、研究者、一期临床试验中心数量。看到这些数据,你是否和我又同样的疑问?
Q1:药物临床试验开始执行机构的备案管理,那医疗器械是不是也要发布医疗器械临床试验机构管理规定,采取备案制管理呢?
A1:实际上国家食品药品监管总局、国家卫生计生委早在2017年就联合发布了《医疗器械临床试验机构条件和备案管理办法》。

同行的小伙伴,应该都了解咱医疗器械临床试验的发展一直是滞后于药物的,无论是试验的复杂程度还是监管力度都紧随在药物其后,但这一次备案制却是医疗器械先行推广的,是不是暗示备案制的改革早就蓄势待发呢?!
Q2:从文章数据可以看到有部分已备案机构是之前未进行认证的机构,而这些机构这次的成功备案会不会给大家带来一丝丝担忧?这些机构是否真的适合开展临床试验?
A2:我为大家对比一下资格认定的条件!经过一番对比,我发现备案制的条件较之前变得更为严谨严格了,不仅数量由之前的9条变成12条(详见下表),而且每条的描述更为详尽,在很多方面提出了更高的要求;另外备案制在机构范围方面也由原来的大部分是医疗机构、医学研究院所进行认定扩大到符合条件的医疗机构、医学研究机构和医药高等学校及社会力量投资设立的临床试验机构均可备案,这在很大程度上解决了我国临床试验机构紧缺的情况。我还注意到这次药物临床试验机构备案的条件中把具备急危重病症抢救的条件和具有伦理委员会的要求单独列明了,这两条都是之前未列明的,这是不是意味着国家越来越注重对受试者权益的保护呢?!
| 药物临床试验机构资格认定办法(试行) 第二章 资格认定的申请 第六条 申请资格认定的医疗机构应具备以下条件: |
| (一)已取得医疗机构执业许可; |
| (二)申请资格认定的专业应与医疗机构执业许可诊疗科目一致; |
| (三)具有与药物临床试验相适应的设备设施; |
| (四)具有与承担药物临床试验相适应的诊疗技术能力; |
| (五)具有与承担药物临床试验相适应的床位数和受试者人数; |
| (六)具有承担药物临床试验的组织管理机构和人员; |
| (七)具有能够承担药物临床试验的研究人员并经过药物临床试验技术与法规的培训; |
| (八)具有药物临床试验管理制度和标准操作规程; |
| (九)具有防范和处理药物临床试验中突发事件的管理机制和措施。 |
| 药物临床试验机构管理规定 第二章 条件和备案 第五条 药物临床试验机构应当具备的基本条件 |
| (一)具有医疗机构执业许可证,具有二级甲等以上资质,试验场地应当符合所在区域卫生健康主管部门对院区(场地)管理规定。开展以患者为受试者的药物临床试验的专业应当与医疗机构执业许可的诊疗科目相一致。开展健康受试者的Ⅰ期药物临床试验、生物等效性试验应当为Ⅰ期临床试验研究室专业; |
| (二)具有与开展药物临床试验相适应的诊疗技术能力; |
| (三)具有与药物临床试验相适应的独立的工作场所、独立的临床试验用药房、独立的资料室,以及必要的设备设施; |
| (四)具有掌握药物临床试验技术与相关法规,能承担药物临床试验的研究人员;其中主要研究者应当具有高级职称并参加过3个以上药物临床试验; |
| (五)开展药物临床试验的专业具有与承担药物临床试验相适应的床位数、门急诊量; |
| (六)具有急危重病症抢救的设施设备、人员与处置能力; |
| (七)具有承担药物临床试验组织管理的专门部门; |
| (八)具有与开展药物临床试验相适应的医技科室,委托医学检测的承担机构应当具备相应资质; |
| (九)具有负责药物临床试验伦理审查的伦理委员会; |
| (十)具有药物临床试验管理制度和标准操作规程; |
| (十一)具有防范和处理药物临床试验中突发事件的管理机制与措施; |
| (十二)卫生健康主管部门规定的医务人员管理、财务管理等其他条件。 |
Q3:机构认证为什么要改为机构备案呢?
A3:官方说:“这一举措有利于释放临床试验资源,更好地满足药物研发对药物临床试验的需求,对鼓励药物创新、促进产业健康发展具有重要意义。各省级药品监督管理局要高度重视《规定》实施工作,加强监督指导,做好本行政区域内药物临床试验机构备案管奇亿娱乐作。”我单纯的以为这次的变革只是时代发展的产物,经过一番仔细研究,发现之前认证的过程是又繁琐又费时,确实跟不上医疗行业快速发展的脚步。
关于流程,为大家简单整理了一下:
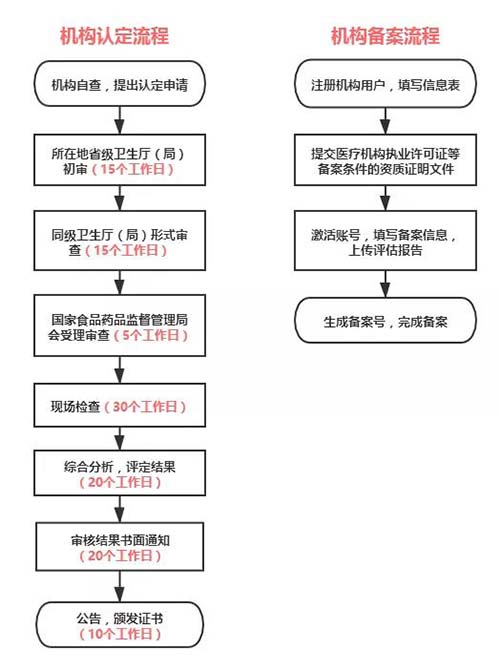
不难发现之前认证的过程不仅要接受层层检查还要等待无数个工作日,但是!现在的药物临床试验机构备案只需按照要求线上完成即可。结果显而易见,备案制在一定程度上更节省人力物力效率更高,在面对一些急症、罕见病等缺少合适的临床试验机构的情况下,是不是可以尽快解决客观困难呢!
Q4:那对临床试验会有什么影响呢?
A4:从现有数据看,现在可开展的临床试验的机构越来越多,从《药物临床试验机构管理规定》来看,临床试验的标准越来越严谨,国家的监管也会越来越严格,这不仅意味着以后在筛选中心的时候选择更多了,更意味着我国临床试验的大环境越来越优越,使用药品的安全性也将会大幅度提高,是一件你好我好大家好的变革。
最后,不得不说这次新冠肺炎着实让“高冷”的临床试验又一次贴近了大众的生活,蹭新冠肺炎的热度让国家为临床试验代了一次言,再有严格监管的加持,临床试验定将不断向前发展。最后的最后,需要代理药物/医疗器械临床机构备案服务,欢迎咨询我。
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
奇亿娱乐(中国)有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。